
Polaritate (chimie) molecule polare și exemple
polaritatea chimică este o proprietate care se caracterizează prin prezența unei distribuții eterogene marcate a densităților electronice într-o moleculă. Prin urmare, în structura sa, există regiuni încărcate negativ (δ-), iar altele încărcate pozitiv (δ +), generând un moment dipolar.
Momentul dipolar de legare (µ) este un mod de a exprima polaritatea unei molecule. De obicei este reprezentat ca un vector a cărui origine este în sarcină (+) și capătul său este situat în sarcină (-), deși unii chimiști îl reprezintă invers.
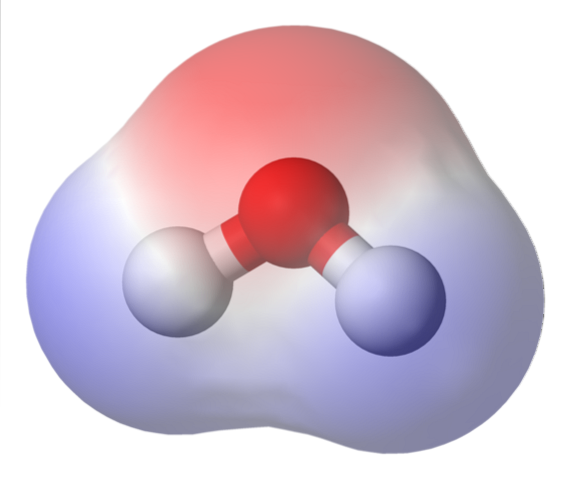
Imaginea de sus arată harta potențialului electrostatic pentru apă, HDouăO. Regiunea roșiatică (atomul de oxigen) corespunde celei cu cea mai mare densitate de electroni și se poate observa, de asemenea, că se remarcă peste regiunile albastre (atomii de hidrogen).
Deoarece distribuția acestei densități de electroni este eterogenă, se spune că există un pol pozitiv și unul negativ. De aceea se vorbește despre „polaritatea” chimică și despre momentul dipolar.
Indice articol
- 1 moment dipol
- 1.1 Asimetria în molecula de apă
- 2 molecule polare
- 3 Exemple
- 3.1 SO2
- 3,2 CHCl3
- 3,3 HF
- 3,4 NH3
- 3.5 Macromolecule cu heteroatomi
- 4 Referințe
Momentul dipol
Momentul dipolar µ este definit de următoarea ecuație:
µ = δd
Unde δ este sarcina electrică a fiecărui pol, pozitivă (+ δ) sau negativă (-δ) și d este distanța dintre ele.
Momentul dipolar este de obicei exprimat în debye, reprezentat de simbolul D. Un coulomb · metru este egal cu 2,998 · 1029 D.
Valoarea momentului dipolar al legăturii dintre doi atomi diferiți este în raport cu diferența de electronegativități a atomilor care formează legătura..
Pentru ca o moleculă să fie polară, nu este suficient să existe legături polare în structura sa, ci trebuie să aibă și o geometrie asimetrică; în așa fel încât să împiedice momentele dipolare să anuleze vectori reciproci.
Asimetrie în molecula de apă
Molecula de apă are două legături O-H. Geometria moleculei este unghiulară, adică sub forma unui „V”; deci momentele dipolare ale legăturilor nu se anulează reciproc, ci mai degrabă suma acestora este produsă îndreptată spre atomul de oxigen.
Harta potențialului electrostatic pentru HDouăSau reflectă acest lucru.
Dacă se observă molecula unghiulară H-O-H, poate apărea următoarea întrebare: este într-adevăr asimetrică? Dacă o axă imaginară este trasă prin atomul de oxigen, molecula se va împărți în două jumătăți egale: H-O | O-H.
Dar nu este așa dacă axa imaginară este orizontală. Când această axă împarte acum molecula din nou în două jumătăți, vom avea atomul de oxigen pe o parte, iar cei doi atomi de hidrogen pe cealaltă..
Din acest motiv, simetria aparentă a lui HDouăSau încetează să mai existe și, prin urmare, este considerată o moleculă asimetrică.
Molecule polare
Moleculele polare trebuie să îndeplinească o serie de caracteristici, cum ar fi:
-Distribuția sarcinilor electrice în structura moleculară este asimetrică.
-De obicei sunt solubile în apă. Acest lucru se datorează faptului că moleculele polare pot interacționa prin forțe dipol-dipol, unde apa se caracterizează prin faptul că are un moment dipol mare.
În plus, constanta sa dielectrică este foarte mare (78,5), ceea ce îi permite să mențină sarcinile electrice separate, crescând solubilitatea..
-În general, moleculele polare au puncte de fierbere și de topire ridicate.
Aceste forțe sunt constituite de interacțiunea dipol-dipol, forțele dispersive londoneze și formarea de legături de hidrogen..
-Datorită încărcării lor electrice, moleculele polare pot conduce electricitatea.
Exemple
SWDouă
Dioxid de sulf (SODouă). Oxigenul are o electronegativitate de 3,44, în timp ce electronegativitatea sulfului este 2,58. Prin urmare, oxigenul este mai electronegativ decât sulful. Există două legături S = O, O având o sarcină δ și sarcina S a a+.
Deoarece este o moleculă unghiulară cu S la vârf, cele două momente dipolare sunt orientate în aceeași direcție; și, prin urmare, se adună, formând molecula SODouă fii polar.
CHCI3
Cloroform (HCCl3). Există o legătură C-H și trei legături C-Cl.
Electronegativitatea lui C este 2,55, iar electronegativitatea lui H este de 2,2. Astfel, carbonul este mai electronegativ decât hidrogenul; și, prin urmare, momentul dipolar va fi orientat de la H (δ +) către C (δ-): Cδ--Hδ+.
În cazul legăturilor C-Cl, C are o electronegativitate de 2,55, în timp ce Cl are o electronegativitate de 3,16. Vectorul dipol sau momentul dipol este orientat de la C spre Cl în cele trei legături C δ+-Cl δ-.
Deoarece există o regiune săracă în electroni, în jurul atomului de hidrogen, și o regiune bogată în electroni formată din cei trei atomi de clor, CHCl3 este considerată o moleculă polară.
HF
Fluorul de hidrogen are o singură legătură H-F. Electronegativitatea lui H este de 2,22, iar electronegativitatea lui F este de 3,98. Prin urmare, fluorul ajunge la cea mai mare densitate de electroni, iar legătura dintre ambii atomi este descrisă cel mai bine ca: Hδ+-Fδ-.
NH3
Amoniac (NH3) are trei legături N-H. Electronegativitatea lui N este 3,06, iar electronegativitatea lui H este 2,22. În toate cele trei legături, densitatea electronilor este orientată spre azot, fiind și mai mare datorită prezenței unei perechi de electroni liberi.
Molecula de NH3 este tetraedric, atomul de N ocupând vârful. Cele trei momente dipolare, corespunzătoare legăturilor N-H, sunt orientate în aceeași direcție. În ele, δ- este situat în N, iar δ + în H. Astfel, legăturile sunt: Nδ--Hδ+.
Aceste momente dipolare, asimetria moleculei și perechea liberă de electroni pe azot fac din amoniac o moleculă extrem de polară..
Macromolecule cu heteroatomi
Când moleculele sunt foarte mari, nu mai este sigur să le clasificăm ca fiind apolare sau polare. Acest lucru se datorează faptului că pot exista părți ale structurii sale cu caracteristici atât apolare (hidrofobe), cât și polare (hidrofile)..
Aceste tipuri de compuși sunt cunoscuți sub numele de amfifile sau amfipatice. Deoarece partea apolară poate fi considerată săracă în electroni în raport cu partea polară, există o polaritate prezentă în structură, iar compușii amfifilici sunt considerați a fi compuși polari..
O macromoleculă cu heteroatomi poate fi în general de așteptat să aibă momente de dipol și, prin urmare, polaritate chimică..
Heteroatomii sunt înțelese a fi acelea care sunt diferite de cele care alcătuiesc scheletul structurii. De exemplu, scheletul de carbon este biologic cel mai important dintre toate, iar atomul cu care carbonul formează o legătură (pe lângă hidrogen) este numit heteroatom..
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Prof. Krishnan. (2007). Compuși polari și nepolari. Colegiul Comunitar St. Louis. Recuperat de la: users.stlcc.edu
- Murmson, Serm. (14 martie 2018). Cum se explică polaritatea. Știința. Recuperat de pe: sciencing.com
- Helmenstine, Anne Marie, dr. (5 decembrie 2018). Definiția și exemplele legăturii polare (legătura covalentă polară). Recuperat de pe: thoughtco.com
- Wikipedia. (2019). Polaritatea chimică. Recuperat de pe: en.wikipedia.org
- Quimitube. (2012). Legătură covalentă: polaritatea legăturii și polaritatea moleculară. Recuperat de pe: quimitube.com



Nimeni nu a comentat acest articol încă.