
Proprietăți coligative (cu formule)
proprietate coligativă este orice proprietate a unei substanțe care depinde sau variază în funcție de numărul de particule prezente în ea (sub formă de molecule sau atomi), fără a depinde de natura acestor particule.
Cu alte cuvinte, acestea pot fi explicate și ca proprietăți ale soluțiilor care depind de relația dintre numărul de particule dizolvate și numărul de particule de solvent. Acest concept a fost introdus în 1891 de chimistul german Wilhelm Ostwald, care a clasificat proprietățile solutului în trei categorii.

Aceste categorii au proclamat că proprietățile coligative depindeau exclusiv de concentrația și temperatura solutului și nu de natura particulelor sale..
Mai mult, proprietățile aditive, cum ar fi masa, depindeau de compoziția solutului, iar proprietățile constituționale depindeau mai mult de structura moleculară a solutului..
Indice articol
- 1 Proprietăți colective
- 1.1 Scăderea presiunii vaporilor
- 1.2 Creșterea temperaturii de fierbere
- 1.3 Scăderea temperaturii de îngheț
- 1.4 Presiunea osmotică
- 2 Referințe
Proprietati coligative
Proprietățile coligative sunt studiate în principal pentru soluții diluate (datorită comportamentului lor aproape ideal) și sunt după cum urmează:
Scăderea presiunii vaporilor
Se poate spune că presiunea de vapori a unui lichid este presiunea de echilibru a moleculelor de vapori cu care lichidul este în contact.
De asemenea, relația acestor presiuni este explicată cu legea lui Raoult, care exprimă faptul că presiunea parțială a unui component este egală cu produsul fracției molare a componentului prin presiunea de vapori a componentului în stare pură:
PLA = XLA . PºLA
În această expresie:
PLA = Presiunea parțială a vaporilor componentului A din amestec.
XLA = Fracția molară a componentei A.
PºLA= Presiunea de vapori a componentei pure A.
În cazul scăderii presiunii de vapori a unui solvent, aceasta are loc atunci când i se adaugă un solut nevolatil pentru a forma o soluție. După cum se știe și prin definiție, o substanță nevolatilă nu are tendința de a se evapora.
Din acest motiv, cu cât acest solvent este adăugat mai mult solventului volatil, cu atât va fi mai mică presiunea de vapori și cu atât mai puțin solvent poate scăpa pentru a deveni o stare gazoasă..
Deci, atunci când solventul se evaporă în mod natural sau forțat, o cantitate de solvent va rămâne în cele din urmă fără a se evapora împreună cu solutul nevolatil..
Acest fenomen poate fi explicat mai bine cu conceptul de entropie: atunci când moleculele fac o tranziție de la faza lichidă la faza gazoasă, entropia sistemului crește..
Aceasta înseamnă că entropia acestei faze gazoase va fi întotdeauna mai mare decât cea a stării lichide, deoarece moleculele de gaz ocupă un volum mai mare..
Apoi, dacă entropia stării lichide crește prin diluare, chiar dacă este legată de un dizolvat, diferența dintre cele două sisteme scade. Din acest motiv, scăderea entropiei scade și presiunea vaporilor..
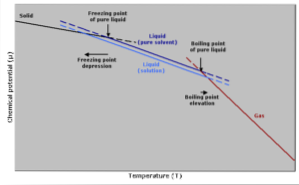
Creșterea temperaturii de fierbere
Punctul de fierbere este acea temperatură la care există echilibru între fazele lichide și gazoase. În acest moment, numărul de molecule de gaz care devin lichide (condensare) este egal cu numărul de molecule de lichid care se evaporă în gaz..
Adăugarea unui dizolvat determină diluarea concentrației moleculelor lichide, determinând scăderea vitezei de evaporare. Aceasta generează o modificare a punctului de fierbere, pentru a compensa schimbarea concentrației solventului..
Cu alte cuvinte mai simple, temperatura de fierbere a unei soluții este mai mare decât cea a solventului în stare pură. Aceasta se exprimă printr-o expresie matematică prezentată mai jos:
ΔTb = i. Kb . m
În această expresie:
ΔTb = Tb (soluție) - Tb (solvent) = Variația temperaturii de fierbere.
i = nu este factorul Hoff.
Kb = Constanta de fierbere a solventului (0,512 ºC / mol pentru apă).
m = Molalitate (mol / kg).
Reducerea temperaturii de congelare
Temperatura de îngheț a unui solvent pur va scădea atunci când se adaugă o cantitate de substanță dizolvată, deoarece este afectată de același fenomen în care scade presiunea vaporilor..
Acest lucru se întâmplă deoarece, prin scăderea presiunii de vapori a solventului prin diluarea unei substanțe dizolvate, va fi necesară o temperatură mai scăzută pentru a-l îngheța..
Natura procesului de înghețare poate fi, de asemenea, luată în considerare pentru a explica acest fenomen: pentru ca un lichid să înghețe, trebuie să ajungă la o stare ordonată în care ajunge să formeze cristale..
Dacă există impurități în lichid sub formă de substanțe dizolvate, lichidul va fi mai puțin ordonat. Din acest motiv, soluția va avea dificultăți mai mari de îngheț decât un solvent fără impurități..
Această reducere este exprimată ca:
ΔTF = -i. KF . m
În expresia de mai sus:
ΔTF = TF (soluție) - TF (solvent) = Variația temperaturii de îngheț.
i = nu este factorul Hoff.
KF = Constanta de congelare a solventului (1,86 ºC kg / mol pentru apă).
m = Molalitate (mol / kg).
Presiune osmotica
Procesul cunoscut sub numele de osmoza este tendința unui solvent de a trece printr-o membrană semipermeabilă de la o soluție la alta (sau de la un solvent pur la o soluție).
Această membrană reprezintă o barieră prin care pot trece unele substanțe și altele nu, ca în cazul membranelor semipermeabile din pereții celulari ai celulelor animale și vegetale..
Presiunea osmotică este apoi definită ca presiunea minimă care trebuie aplicată unei soluții pentru a opri trecerea solventului său pur printr-o membrană semipermeabilă..
Este, de asemenea, cunoscut sub numele de măsura tendinței unei soluții de a primi solventul pur datorită efectului osmozei. Această proprietate este coligativă deoarece depinde de concentrația solutului din soluție, care este exprimată ca o expresie matematică:
Π. V = n. R. T sau, de asemenea, π = M. R. T
În aceste expresii:
n = Numărul de moli de particule din soluție.
R = Constanta gazului universal (8.314472 J. K-1 . cârtiță-1).
T = Temperatura în Kelvin.
M = Molaritate.
Referințe
- Wikipedia. (s.f.). Proprietati coligative. Adus de pe en.wikipedia.org
- Î.Hr. (s.f.). Proprietati coligative. Recuperat de pe opentextbc.ca
- Bosma, W. B. (s.f.). Proprietati coligative. Adus de la chemistryexplained.com
- Note de scânteie. (s.f.). Proprietati coligative. Recuperat de la sparknotes.com
- Universitatea, F. S. (s.f.). Proprietati coligative. Adus de la chem.fsu.edu



Nimeni nu a comentat acest articol încă.