
Tipuri și funcții de proteoliză

proteoliză o degradarea proteinelor este un proces prin care proteinele unei celule pot fi degradate complet (până la aminoacizii lor constituenți) sau parțial (producând peptide). Adică, constă în hidroliza uneia sau mai multor legături peptidice care își mențin aminoacizii laolaltă..
Acest proces poate avea loc datorită participării altor proteine cu activitate enzimatică, în ale căror locuri active are loc hidroliza legăturilor. Poate apărea și prin „metode” non-enzimatice, cum ar fi prin acțiunea căldurii sau a substanțelor cu pH extrem (foarte acid sau foarte bazic).
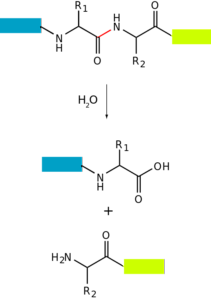
Degradarea proteinelor are loc la bacterii, animale și plante, dar este deosebit de frecventă la animale, în special la nivelul sistemului digestiv, întrucât de aceasta depinde digestia și absorbția intestinală a proteinelor ingerate cu dieta..
În plus, proteoliza are o importanță maximă pentru menținerea funcțională și reglarea mai multor procese celulare și are, de asemenea, legătură cu eliminarea acelor proteine care prezintă erori în traducere, îndoire, ambalare, import, operare etc..
Este important să subliniem că este un proces ireversibil, extrem de eficient, care funcționează și în „reglarea regulatorilor”, deoarece elimină nu numai acele proteine care au activități biologice „directe”, ci și cele care reglează alte proteine sau expresia a genelor corespunzătoare.
Indice articol
- 1 Tipuri de proteoliză
- 1.1 Proteoliza ubiquitinării
- 1.2 Proteoliza prin autofagie
- 1.3 Proteoliza neenzimatică
- 2 Funcții
- 2.1 În sistemul imunitar
- 2.2 Alte funcții
- 2.3 La plante
- 3 Referințe
Tipuri de proteoliză
Proteinele interne ale unei celule pot fi degradate aleatoriu sau selectiv sau, ceea ce este același lucru, într-un mod controlat sau nu. La rândul său, așa cum s-a menționat anterior, acest proces poate avea loc prin intermediul unor enzime speciale sau datorită condițiilor de mediu definite, cum ar fi pH-ul acid și / sau alcalin..
Este important de menționat faptul că orice proteină corect tradusă, pliată sau ambalată ascunde una sau mai multe secvențe de semnal de degradare care sunt „criptice” și care pot fi expuse atunci când proteina este perturbată structural de temperatură, pH etc..
Proteoliza ubiquitinării
Ubiquitinarea (sistem ubiquitin-proteazom) este un sistem prin care proteinele pot fi hidrolizate selectiv după ce sunt marcate în mod specific pentru degradare, proces care poate avea loc atât în citosol, cât și în nucleul celular.
Acest sistem are capacitatea de a recunoaște și distruge proteinele marcate în nucleu și în citosol, precum și de a degrada proteinele care nu se pliază corect în timpul translocației lor din citosol în reticulul endoplasmatic..
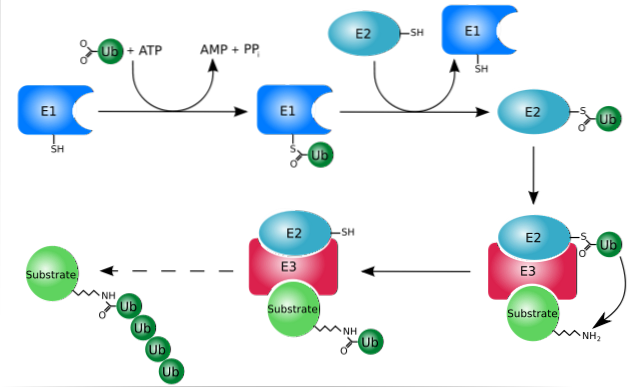
Funcționează în principal prin adăugarea sau conjugarea proteinelor „țintă” la o mică proteină sau peptidă de 76 de reziduuri de aminoacizi, mai bine cunoscută sub numele de ubiquitină. Aceste proteine „marcate” prin ubiquitinare sunt degradate în fragmente mici de către proteazomul 26S, o protează cu mai multe subunități..
Proteoliza prin autofagie
Autofagia este, de asemenea, considerată de unii autori ca o formă de proteoliză, cu distincția că apare într-un compartiment membranos închis care este îndreptat spre lizozomi (în celulele animale), unde proteinele conținute în interior sunt degradate de proteazele lizozomale..
Proteoliză neenzimatică
Temperatura, pH-ul și chiar concentrația de sare a unui mediu pot provoca hidroliza legăturilor peptidice care țin împreună aminoacizii diferitelor tipuri de proteine, care are loc prin destabilizarea și întreruperea legăturilor..
Caracteristici
Proteoliza are multe funcții în organismele vii. În special, are de-a face cu transformarea proteinelor, prin care unele molecule de proteine specifice care au fost traduse de la unul sau mai mulți ribozomi sunt în cele din urmă degradate la viteze diferite..
Proteinele au un timp de înjumătățire care variază de la câteva secunde la câteva luni și produsele degradării lor, fie că sunt reglementate sau nu, mediate de enzime sau nu, sunt în general reutilizate pentru sinteza proteinelor noi, care probabil îndeplinesc funcții diferite..
Așa se întâmplă cu proteinele care sunt consumate împreună cu alimentele, care sunt degradate în tractul gastrointestinal de proteaze, inclusiv tripsină și pepsină; precum și cu unele proteine celulare atunci când celulele nu au suficientă hrană pentru a supraviețui.
Sistemele proteolitice intracelulare detectează și elimină proteinele „anormale” care sunt potențial toxice pentru celule, deoarece acestea pot interacționa cu liganzi „fiziologic inadecvați”, pe lângă producerea de agregate care provoacă impedimente mecanice și fizice proceselor celulare normale..
Acumularea de proteine anormale în interiorul celulei, fie datorită defectelor sistemului proteolitic intern, fie din alte motive, este ceea ce mulți oameni de știință consideră a fi una dintre principalele cauze ale îmbătrânirii la ființele vii multicelulare..
În sistemul imunitar
Proteoliza parțială a multor proteine din surse exogene sau străine, cum ar fi microorganismele invadatoare, de exemplu, este un proces fundamental pentru sistemul de răspuns imunitar, deoarece limfocitele T recunosc fragmentele scurte, un produs al proteolizei (peptidelor) care le sunt prezentate. în asociere cu un set de proteine de suprafață.
Aceste peptide pot proveni din sistemul de ubiquitinare, procese autofagice sau evenimente de proteoliză necontrolate..
Alte funcții
O altă funcție a proteolizei limitate sau parțiale este modificarea proteinelor nou formate, care funcționează ca un „preparat” pentru funcțiile lor intra- sau extracelulare. Acest lucru este adevărat, de exemplu, pentru anumiți hormoni și pentru proteinele implicate în diferite procese metabolice..
Moartea celulară programată (apoptoza) depinde, în mare măsură, de proteoliza „sit-specifică” limitată sau parțială a proteinelor intracelulare, care este mediată de o cascadă de proteaze specifice numite caspaze..
Sistemele de reglare extracelulară depind, de asemenea, de proteoliza site-specific și cel mai proeminent exemplu este cel al coagulării sângelui..
Proteoliza generală sau completă îndeplinește, de asemenea, funcții esențiale pentru degradarea selectivă a acelor proteine a căror concentrație trebuie controlată cu atenție în funcție de fiziologia, metabolica sau dezvoltarea celulelor..
La plante
Plantele folosesc, de asemenea, procese proteolitice pentru a controla multe dintre aspectele lor fiziologice și de dezvoltare. Funcționează, de exemplu, în menținerea condițiilor intracelulare și în mecanismele de răspuns la condiții stresante, cum ar fi seceta, salinitatea, temperatura, printre altele..
Ca și la animale, proteoliza la plante colaborează la activarea și maturizarea zimogenilor (proteine inactive), controlează metabolismul, homeostazia, procesele programate de moarte celulară, dezvoltarea țesuturilor și organelor etc. La aceste organisme calea proteolizei prin ubiquitinare este una dintre cele mai importante.
Referințe
- Alberts, B., Bray, D., Hopkin, K., Johnson, A. D., Lewis, J., Raff, M., ... și Walter, P. (2013). Biologie celulară esențială. Știința ghirlandelor.
- Maurizi, M. R. (1992). Proteazele și degradarea proteinelor în Escherichia coli. Experientia, 48 (2), 178-201.
- Varshavsky, A. (2005). Degradarea proteică reglementată. Tendințe în științele biochimice, 30 (6), 283-286.
- Vierstra, R. D. (1996). Proteoliza la plante: mecanisme și funcții. În controlul post-transcripțional al expresiei genelor la plante (pp. 275-302). Springer, Dordrecht.
- Wolf, D. H. și Menssen, R. (2018). Mecanisme de reglare-proteoliză celulară, marea surpriză. Scrisori FEBS, 592 (15), 2515-2524.


Nimeni nu a comentat acest articol încă.