
Care este căldura reacției?

căldura de reacție sau Entalpia de reacție (ΔH) este modificarea entalpiei unei reacții chimice care are loc la presiune constantă. Este o unitate de măsură termodinamică utilă pentru a calcula cantitatea de energie pe mol care este eliberată sau produsă într-o reacție.
Deoarece entalpia este derivată din presiune, volum și energie internă, toate acestea fiind funcții de stare, entalpia este, de asemenea, o funcție de stare..
ΔH, sau schimbarea entalpiei a apărut ca o unitate de măsură destinată să calculeze schimbarea de energie a unui sistem atunci când a devenit prea dificil să se găsească ,U, sau schimbarea energiei interne a unui sistem, măsurând simultan cantitatea de căldură și munca schimbată.
Având o presiune constantă, modificarea entalpiei este egală cu căldura și poate fi măsurată ca ΔH = q.
Notația ΔHº sau ΔHºr apare apoi pentru a explica temperatura precisă și presiunea căldurii de reacție ΔH.
Entalpia standard a reacției este simbolizată prin ΔHº sau ΔHºrxn și poate asuma atât valori pozitive, cât și negative. Unitățile pentru ΔHº sunt kiloJoule pe mol sau kj / mol.
Concept anterior pentru a înțelege căldura reacției: diferențe între ΔH și ΔHºr.
Δ = reprezintă schimbarea entalpiei (entalpia produselor minus entalpia reactanților).
O valoare pozitivă indică faptul că produsele au entalpie mai mare sau că este o reacție endotermă (este necesară căldură).
O valoare negativă indică faptul că reactanții au entalpie mai mare sau că este o reacție exotermă (se produce căldură).
º = înseamnă că reacția este o modificare de entalpie standard și are loc la o presiune / temperatură prestabilită.
r = denotă faptul că această modificare este entalpia reacției.
Starea standard: starea standard a unui solid sau lichid este substanța pură la o presiune de 1 bar sau ceea ce este aceeași atmosferă (105 Pa) și o temperatură de 25 ° C, sau ceea ce este același 298 K.
ΔHºr este căldura standard a reacției sau entalpia standard a unei reacții și, ca ΔH, măsoară și entalpia unei reacții. Cu toate acestea, ΔHºrxn are loc în condiții „standard”, ceea ce înseamnă că reacția are loc la 25 ° C și 1 atm..
Avantajul măsurării ΔH în condiții standard constă în capacitatea de a raporta o valoare ΔHº la alta, deoarece acestea apar în aceleași condiții.
Căldura de formare
Căldura standard de formare, ΔHFº, dintr-un produs chimic este cantitatea de căldură absorbită sau eliberată de la formarea a 1 mol din substanța chimică respectivă la 25 grade Celsius și 1 bar din elementele sale în stările lor standard.
Un element este în starea sa standard dacă este în forma sa cea mai stabilă și starea sa fizică (solid, lichid sau gazos) la 25 de grade Celsius și 1 bar.
De exemplu, căldura standard de formare a dioxidului de carbon implică oxigen și carbon ca reactanți..
Oxigenul este mai stabil ca moleculele de gaz ODouă, în timp ce carbonul este mai stabil ca grafitul solid. (Grafitul este mai stabil decât diamantul în condiții standard).
Pentru a exprima definiția într-un alt mod, căldura standard de formare este un tip special de căldură standard de reacție..
Reacția este formarea a 1 mol dintr-o substanță chimică din elementele sale în stările lor standard în condiții standard.
Căldura standard de formare este numită și entalpia standard de formare (deși este de fapt o modificare a entalpiei).
Prin definiție, formarea unui element din sine nu ar produce nicio modificare a entalpiei, astfel că căldura standard de reacție pentru toate elementele este zero (Cai, 2014).
Calculul entalpiei de reacție
1- Calcul experimental
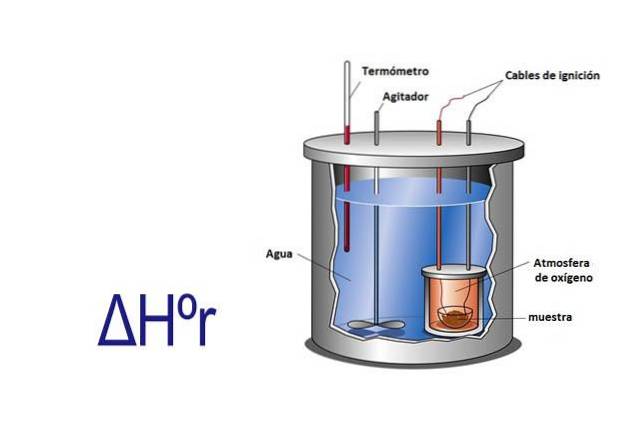
Entalpia poate fi măsurată experimental folosind un calorimetru. Un calorimetru este un instrument în care o probă reacționează prin cabluri electrice care furnizează energia de activare. Eșantionul se află într-un recipient înconjurat de apă care se agită constant.
Măsurând cu o schimbarea de temperatură care apare atunci când proba reacționează și cunoașterea căldurii specifice a apei și a masei acesteia, căldura eliberată sau absorbită de reacție este calculată folosind ecuația q = Cesp x m x ΔT.
În această ecuație q este căldură, Cesp este căldura specifică în acest caz a apei care este egală cu 1 calorie pe gram, m este masa apei și ΔT este schimbarea temperaturii.
Calorimetrul este un sistem izolat care are o presiune constantă, deci ΔHr= q
2- Calcul teoretic
Modificarea entalpiei nu depinde de calea particulară a unei reacții, ci doar de nivelul energetic global al produselor și reactanților. Entalpia este o funcție de stare și, ca atare, este aditivă.
Pentru a calcula entalpia standard a unei reacții, putem adăuga entalpii standard de formare a reactanților și o putem scădea din suma entalpiei standard de formare a produselor (Boundless, S.F.). Afirmat matematic, acest lucru ne oferă:
ΔHr° = Σ ΔHFº (produse) - Σ ΔHFº (reactanți).
Entalpii de reacții sunt calculate de obicei din entalpii de formare a reactantului în condiții normale (presiune de 1 bar și temperatură 25 grade Celsius).
Pentru a explica acest principiu al termodinamicii, vom calcula entalpia reacției pentru arderea metanului (CH4) conform formulei:
CH4 (g) + 2ODouă (g) → CODouă (g) + 2HDouăO (g)
Pentru a calcula entalpia standard a reacției, trebuie să găsim entalpii standard de formare pentru fiecare dintre reactanții și produsele implicate în reacție..
Acestea se găsesc de obicei într-un apendice sau în diferite tabele online. Pentru această reacție, datele de care avem nevoie sunt:
HFº CH4 (g) = -75 kjoul / mol.
HFº ODouă (g) = 0 kjoul / mol.
HFº CODouă (g) = -394 kjoul / mol.
HFº HDouăO (g) = -284 kjoul / mol.
Rețineți că, deoarece se află în starea sa standard, entalpia standard de formare pentru oxigenul gazos este de 0 kJ / mol.
Aici vom rezuma entalpiile noastre standard de formare. Rețineți că, deoarece unitățile sunt în kJ / mol, trebuie să ne înmulțim cu coeficienții stoichiometrici în ecuația de reacție echilibrată (Leaf Group Ltd, S.F.).
Σ ΔHFº (produse) = ΔHFº CODouă +2 ΔHFº HDouăSAU
Σ ΔHFº (produse) = -1 (394 kjoul / mol) -2 (284 kjoul / mol) = -962 kjoul / mol
Σ ΔHFº (reactanți) = ΔHFº CH4 + ΔHFº ODouă
Σ ΔHFº (reactanți) = -75 kjoul / mol + 2 (0 kjoul / mol) = -75 kjoul / mol
Acum, putem găsi entalpia standard a reacției:
ΔHr° = Σ ΔHFº (produse) - Σ ΔHFº (reactanți) = (- 962) - (- 75) =
ΔHr° = - 887kJ / mol.
Referințe
- Anne Marie Helmenstine. (2014, 11 iunie). Entalpia definiției reacției. Recuperat de la thoughtco: thoughtco.com.
- (S.F.). Entalpia standard de reacție. Recuperat de la boundless: boundless.com.
- Cai, E. (2014, 11 martie). căldura standard de formare. Recuperat de la Chemicalstatistician: chemicalstatistician.wordpress.com.
- Clark, J. (2013, mai). Diverse definiții ale modificării entalpiei. Recuperat de la chemguide.co.uk: chemguide.co.uk.
- Jonathan Nguyen, G. L. (2017, 9 februarie). Entalpia standard de formare. Recuperat de la chem.libretexts.org: chem.libretexts.org.
- Leaf Group Ltd. (S.F.). Cum se calculează entalpii de reacție. Recuperat de la sciencing: sciencing.com.
- Rachel Martin, E. Y. (2014, 7 mai). Căldura de reacție. Recuperat de la chem.libretexts.org: chem.libretexts.org.


Nimeni nu a comentat acest articol încă.