
Ce este volatilizarea?

volatilizare este procesul de transformare a unei substanțe chimice dintr-o stare lichidă sau solidă într-o stare gazoasă sau vapori. Alți termeni folosiți pentru a descrie același proces sunt vaporizarea, distilarea și sublimarea..
O substanță poate fi adesea separată de alta prin volatilizare și poate fi apoi recuperată prin condensarea vaporilor..

Substanța poate fi mai rapid volatilizată fie prin încălzirea acesteia pentru a-și crește presiunea de vapori, fie prin îndepărtarea vaporilor folosind un curent de gaz inert sau o pompă de vid..
Procedurile de încălzire includ volatilizarea apei, a mercurului sau a triclorurii de arsen pentru a separa aceste substanțe de elementele care interferează..
Reacțiile chimice sunt uneori folosite pentru a produce produse volatile, cum ar fi eliberarea de dioxid de carbon din carbonați, amoniac în metoda Kjeldahl pentru determinarea azotului și a dioxidului de sulf în determinarea sulfului în oțel.
Metodele de volatilizare sunt, în general, caracterizate de o mare simplitate și ușurință în operare, cu excepția cazului în care sunt necesare temperaturi ridicate sau materiale foarte rezistente la coroziune (Louis Gordon, 2014).
Volatilizarea presiunii vaporilor
Știind că temperatura de fierbere a apei este de 100 ° C, v-ați întrebat vreodată de ce se evaporă apa de ploaie??
Este 100 ° C? Dacă da, de ce nu mă încălzesc? V-ați întrebat vreodată ce conferă aroma caracteristică alcoolului, oțetului, lemnului sau plasticului? (Presiunea de vapori, S.F.)
Responsabil pentru toate acestea este o proprietate cunoscută sub numele de presiune de vapori, care este presiunea exercitată de un vapor în echilibru cu faza solidă sau lichidă a aceleiași substanțe..
De asemenea, presiunea parțială a substanței din atmosferă pe solid sau lichid (Anne Marie Helmenstine, 2014).
Presiunea vaporilor este o măsură a tendinței unui material de a trece la starea gazoasă sau vapori, adică o măsură a volatilității substanțelor.
Pe măsură ce presiunea vaporilor crește, cu atât este mai mare capacitatea lichidului sau solidului de a se evapora, fiind astfel mai volatilă..
Presiunea vaporilor va crește odată cu temperatura. Temperatura la care presiunea vaporilor de pe suprafața unui lichid este egală cu presiunea exercitată de mediu se numește punctul de fierbere al lichidului (Encyclopædia Britannica, 2017).
Presiunea vaporilor va depinde de soluția dizolvată în soluție (este o proprietate coligativă). Pe suprafața soluției (interfața aer-gaz), cele mai superficiale molecule tind să se evapore, schimbând între faze și generând o presiune de vapori..
Prezența solutului scade numărul de molecule de solvent la interfață, reducând presiunea vaporilor..
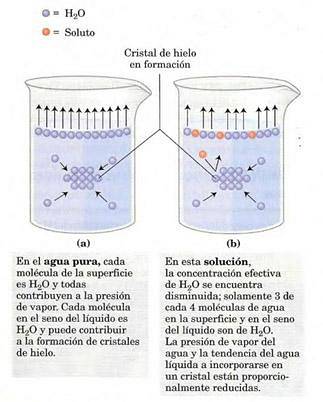
Modificarea presiunii vaporilor poate fi calculată cu Legea lui Raoult pentru substanțele dizolvate nevolatile, care este dată de:
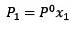
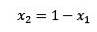
Unde X2 este fracția molară a solventului. Dacă înmulțim ambele părți ale ecuației cu P ° atunci rămâne:
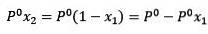
Înlocuirea (1) din (3) este:
(4)
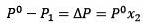
Aceasta este variația presiunii vaporilor atunci când un dizolvat se dizolvă (Jim Clark, 2017).
Analiză gravimetrică
Analiza gravimetrică este o clasă de tehnici de laborator utilizate pentru a determina masa sau concentrația unei substanțe prin măsurarea unei modificări a masei..
Produsul chimic pe care încercăm să îl cuantificăm este uneori numit analit. Am putea folosi analiza gravimetrică pentru a răspunde la întrebări precum:
- Care este concentrația analitului într-o soluție?
- Cât de pur este proba noastră? Eșantionul de aici ar putea fi solid sau în soluție.
Există două tipuri comune de analiză gravimetrică. Ambele implică schimbarea fazei analitului pentru al separa de restul unui amestec, ducând la o schimbare a masei..
Una dintre aceste metode este gravimetria precipitațiilor, dar cea care ne interesează cu adevărat este gravimetria de volatilizare.
Gravimetria de volatilizare se bazează pe descompunerea termică sau chimică a probei și măsurarea modificării rezultate a masei sale..
Alternativ, putem prinde și cântări un produs de descompunere volatil. Deoarece eliberarea unei specii volatile este o parte esențială a acestor metode, le clasificăm colectiv ca metode de analiză gravimetrică de volatilizare (Harvey, 2016).
Problemele de analiză gravimetrică sunt pur și simplu probleme de stoichiometrie cu câțiva pași suplimentari.
Pentru a efectua orice calcul stoichiometric, avem nevoie de coeficienții ecuației chimice echilibrate.
De exemplu, dacă o probă conține clorură de bariu dihidrat (BaClDouă● HDouăO), cantitatea de impurități poate fi obținută prin încălzirea probei pentru evaporarea apei.
Diferența de masă dintre proba originală și proba încălzită ne va oferi, în grame, cantitatea de apă conținută în clorura de bariu.
Cu un calcul stoichiometric simplu, se va obține cantitatea de impurități din eșantion (Khan, 2009).
Distilație fracțională
Distilarea fracționată este un proces prin care componentele unui amestec lichid sunt separate în diferite părți (numite fracții) în funcție de diferitele lor puncte de fierbere.
Diferența de volatilitate a compușilor din amestec joacă un rol fundamental în separarea lor..
Distilarea fracționată este utilizată pentru purificarea substanțelor chimice și, de asemenea, pentru a separa amestecurile pentru a obține componentele lor. Este folosit ca tehnică de laborator și în industrie, unde procesul are o mare importanță comercială.
Vaporii dintr-o soluție de fierbere sunt trecuți printr-o coloană înaltă, numită coloană de fracționare..
Coloana este ambalată cu margele de plastic sau sticlă pentru a îmbunătăți separarea, oferind mai multă suprafață pentru condens și evaporare.
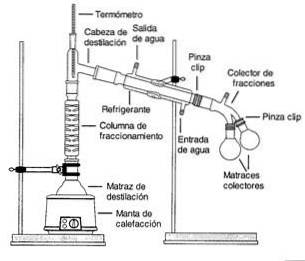
Temperatura coloanei scade treptat de-a lungul lungimii sale. Componentele cu un punct de fierbere mai mare se condensează în coloană și revin la soluție.
Componentele cu puncte de fierbere mai mici (mai volatile) trec prin coloană și sunt colectate în partea de sus.
Teoretic, având mai multe margele sau plăci îmbunătățește separarea, dar adăugarea plăcilor crește, de asemenea, timpul și energia necesară pentru a finaliza o distilare (Helmenstine, 2016)..
Referințe
- Anne Marie Helmenstine. (2014, 16 mai). Definiția presiunii vaporilor. Recuperat de la thoughtco.com.
- Encyclopædia Britannica. (2017, 10 februarie). Presiunea de vapori. Recuperat de la britannica.com.
- Harvey, D. (2016, 25 martie). Gravimetrie de volatilizare. Recuperat din chim.libretexte.
- Helmenstine, A. M. (2016, 8 noiembrie). Definiție și exemple de distilare fracționată. Recuperat de la thoughtco.com.
- Jim Clark, I. L. (2017, 3 martie). Legea lui Raoult. Recuperat din chim.libretexte.
- Khan, S. (2009, 27 august). Introducere în analiza gravimetrică: gravimetria volatilizării. Recuperat de la hanacademy.
- Louis Gordon, R. W. (2014). Recuperat de pe accessscience.com.
- Presiunea de vapori. (S.F.). Recuperat de la chem.purdue.edu.


Nimeni nu a comentat acest articol încă.