
Ce sunt forțele dipol dipol?
dipol forțe dipol sau forțele Keesom sunt acele interacțiuni intermoleculare prezente în molecule cu momente dipolare permanente. Este una dintre forțele Van der Waals și, deși este departe de a fi cea mai puternică, este un factor cheie care explică proprietățile fizice ale multor compuși..
Termenul "dipol" se referă în mod explicit la doi poli: unul negativ și unul pozitiv. Astfel, vorbim de molecule dipolare atunci când au regiuni definite cu densități mari și mici de electroni, ceea ce este posibil doar dacă electronii „migrează” preferențial către anumiți atomi: cel mai electronegativ..
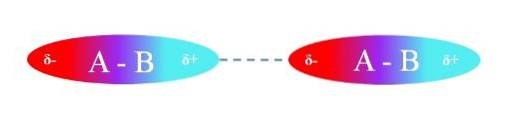
Imaginea superioară ilustrează interacțiunile dipol-dipol între două molecule A-B cu momente dipol permanente. La fel, se poate observa modul în care moleculele sunt orientate astfel încât interacțiunile să fie eficiente. Astfel, regiunea pozitivă δ + atrage regiunea negativă δ-.
Conform celor de mai sus, se poate specifica faptul că aceste tipuri de interacțiuni sunt direcționale (spre deosebire de interacțiunile ionice încărcare-încărcare). Moleculele din mediul lor își orientează polii în așa fel încât, deși sunt slabi, suma tuturor acestor interacțiuni conferă compusului o mare stabilitate intermoleculară..
Acest lucru are ca rezultat faptul că compușii (organici sau anorganici) capabili să formeze interacțiuni dipol-dipol prezintă puncte de fierbere sau de topire ridicate..
Indice articol
- 1 moment dipol
- 1.1 Simetrie
- 1.2 Asimetria în molecule neliniare
- 2 Orientări ale dipolilor
- 3 Interacțiuni prin legături de hidrogen
- 4 Referințe
Momentul dipol
Momentul dipolar µ al unei molecule este o mărime vectorială. Cu alte cuvinte: depinde de direcțiile în care există un gradient de polaritate. Cum și de ce își are originea acest gradient? Răspunsul constă în legături și în natura intrinsecă a atomilor elementelor..
De exemplu, în imaginea superioară A este mai electronegativă decât B, deci în legătura A-B cea mai mare densitate de electroni este situată în jurul valorii de A.
Pe de altă parte, B „renunță” la norul său de electroni și, prin urmare, este înconjurat de o regiune săracă în electroni. Această diferență de electronegativități între A și B creează gradientul de polaritate.
Deoarece o regiune este bogată în electroni (δ-), în timp ce cealaltă este săracă în electroni (δ +), apar cei doi poli care, în funcție de distanțele dintre ei, determină magnitudini diferite de µ, care se determină pentru fiecare compus.
Simetrie
Dacă o moleculă dintr-un anumit compus are µ = 0, atunci se spune că este o moleculă apolară (chiar dacă are gradienți de polaritate).
Pentru a înțelege cum simetria - și, prin urmare, geometria moleculară - joacă un rol important în acest parametru, este necesar să se ia în considerare din nou legătura A-B..
Datorită diferenței în electronegativitățile lor, există regiuni definite bogate și sărace în electroni.
Ce se întâmplă dacă legăturile ar fi A-A sau B-B? În aceste molecule nu ar exista niciun moment dipolar, deoarece ambii atomi atrag spre ele în același mod electronii legăturii (legătură sută la sută covalentă).
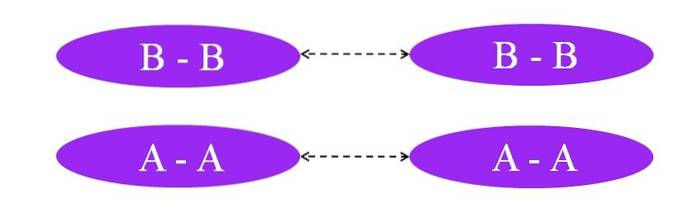
După cum se poate vedea în imagine, nici în molecula A-A, nici în molecula B-B nu există acum regiuni bogate sau sărace în electroni (roșu și albastru). Aici un alt tip de forță este responsabil pentru menținerea împreună a lui ADouă și BDouă: interacțiuni dipol-dipol induse, cunoscute și sub numele de forțe londoneze sau forțe de împrăștiere.
Dimpotrivă, dacă moleculele ar fi de tip AOA sau BOB, ar exista repulsii între polii lor, deoarece au sarcini egale:
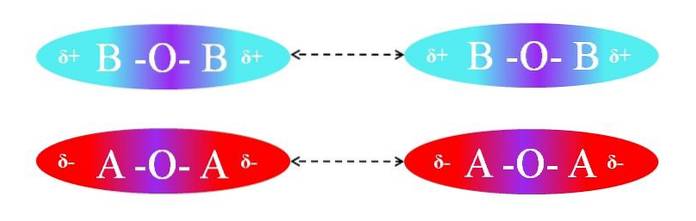
Regiunile δ + ale a două molecule BOB nu permit o interacțiune eficientă dipol-dipol; același lucru este valabil și pentru regiunile δ- ale celor două molecule AOA. La fel, ambele perechi de molecule au µ = 0. Gradientul de polaritate O-A este anulat vectorial cu cel al legăturii A-O.
În consecință, forțele de dispersie intră și ele în joc în perechea AOA și BOB, datorită absenței unei orientări eficiente a dipolilor.
Asimetrie în molecule neliniare
Cel mai simplu caz este cel al moleculei CF.4 (sau tastați CX4). Aici, C are o geometrie moleculară tetraedrică, iar regiunile bogate în electroni sunt la vârfuri, în special pe atomii electronegativi ai lui F.
Gradientul de polaritate C-F se anulează în oricare dintre direcțiile tetraedrului, determinând suma vectorială a tuturor acestora să fie egală cu 0.
Astfel, deși centrul tetraedrului este foarte pozitiv (δ +) și vârfurile sale foarte negative (δ-), această moleculă nu poate forma interacțiuni dipol-dipol cu alte molecule..
Orientări ale dipolilor
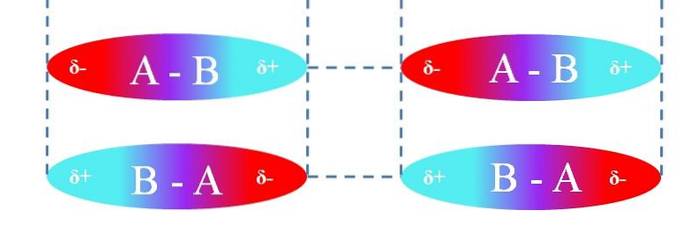
În cazul moleculelor liniare A-B, acestea sunt orientate în așa fel încât formează cele mai eficiente interacțiuni dipol-dipol (așa cum se poate vedea în imaginea de mai sus). Cele de mai sus se aplică în același mod și pentru alte geometrii moleculare; de exemplu, cele unghiulare în cazul moleculelor NODouă.
Astfel, aceste interacțiuni determină dacă compusul A-B este un gaz, un lichid sau un solid la temperatura camerei..
În cazul compușilor ADouă și BDouă (cele ale elipselor violete), este foarte probabil ca acestea să fie gazoase. Cu toate acestea, dacă atomii săi sunt foarte voluminoși și ușor polarizabili (ceea ce crește forțele Londrei), atunci ambii compuși pot fi fie solizi, fie lichizi..
Cu cât interacțiunile dipol-dipol sunt mai puternice, cu atât este mai mare coeziunea dintre molecule; în mod similar, cu atât sunt mai mari punctele de topire și fierbere ale compusului. Acest lucru se datorează faptului că sunt necesare temperaturi mai ridicate pentru a „rupe” aceste interacțiuni..
Pe de altă parte, o creștere a temperaturii face ca moleculele să vibreze, să se rotească și să se miște mai frecvent. Această „agitație moleculară” afectează orientările dipolilor și, prin urmare, forțele intermoleculare ale compusului sunt slăbite..
Interacțiuni cu legătura de hidrogen
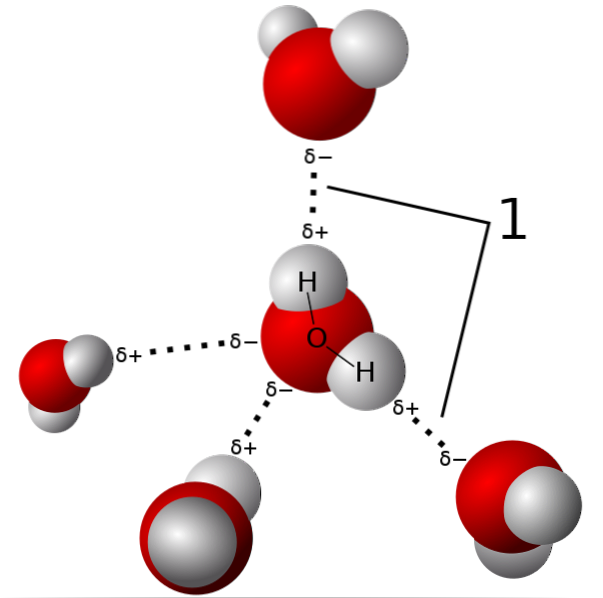
În imaginea de mai sus, cinci molecule de apă sunt prezentate interacționând prin legături de hidrogen. Acesta este un tip special de interacțiuni dipol-dipol. Regiunea săracă în electroni este ocupată de H; iar regiunea bogată în electroni (δ-) este ocupată de atomii extrem de electronegativi N, O și F.
Adică, moleculele cu atomi de N, O și F legați de H pot forma legături de hidrogen..
Astfel, legăturile de hidrogen sunt O-H-O, N-H-N și F-H-F, O-H-N, N-H-O etc. Aceste molecule au momente dipolare permanente și foarte intense, care le orientează corect pentru a „profita” de aceste punți..
Sunt mai slabe din punct de vedere energetic decât orice legătură covalentă sau ionică. Deși, suma tuturor legăturilor de hidrogen din faza unui compus (solid, lichid sau gazos) îl face să prezinte proprietăți care îl definesc ca unic..
De exemplu, acesta este cazul apei, ale cărei legături de hidrogen sunt responsabile pentru punctul său de fierbere ridicat și pentru că sunt mai puțin dense în starea de gheață decât apa lichidă; motiv pentru care aisbergurile plutesc în mări.
Referințe
- Forțele Dipol-Dipol. Adus la 30 mai 2018, de pe: chem.purdue.edu
- Învățare fără limite. Forța Dipol-Dipol. Adus pe 30 mai 2018, de pe: courses.lumenlearning.com
- Jennifer Roushar. (2016). Forțele Dipol-Dipol. Adus pe 30 mai 2018, de pe: sophia.org
- Helmenstine, Anne Marie, dr. (03 mai 2018). Care sunt exemple de legare a hidrogenului? Adus pe 30 mai 2018, de pe: thoughtco.com
- Mathews, C. K., Van Holde, K.E. și Ahern, K.G. (2002) Biochimie. A treia editie. Addison Wesley Longman, Inc., P 33.
- Whitten, Davis, Peck și Stanley. Chimie. (Ed. A VIII-a). CENGAGE Learning, p 450-452.
- Utilizator Qwerter. (16 aprilie 2011). Legături de hidrogen model 3D în toaletă. [Figura]. Adus pe 30 mai 2018, de pe: commons.wikimedia.org


Nimeni nu a comentat acest articol încă.