
Caracteristicile reacției endotermice, ecuații și exemple

A reacție endotermică Este unul care să aibă loc trebuie să absoarbă energie, sub formă de căldură sau radiații, din împrejurimile sale. În general, dar nu întotdeauna, ele pot fi recunoscute printr-o scădere a temperaturii în mediul lor; sau dimpotrivă, au nevoie de o sursă de căldură, cum ar fi cea obținută printr-o flacără aprinsă.
Absorbția energiei sau căldurii este ceea ce au în comun toate reacțiile endotermice; natura lor, precum și transformările implicate, sunt foarte diverse. Câtă căldură ar trebui să absoarbă? Răspunsul depinde de termodinamica sa: temperatura la care reacția are loc spontan.

De exemplu, una dintre cele mai emblematice reacții endotermice este schimbarea stării de la gheață la apă lichidă. Gheața trebuie să absoarbă căldura până când temperatura acesteia ajunge la aproximativ 0 ° C; la temperatura respectivă topirea sa devine spontană, iar gheața se va absorbi până se va topi complet.
În spațiile fierbinți, cum ar fi pe malul unei plaje, temperaturile sunt mai ridicate și, prin urmare, gheața absoarbe mai repede căldura; adică se topește mai repede. Topirea ghețarilor este un exemplu de reacție endotermă nedorită.
De ce se întâmplă așa? De ce gheața nu poate apărea ca un solid fierbinte? Răspunsul constă în energia cinetică medie a moleculelor de apă din ambele stări și în modul în care acestea interacționează între ele prin legăturile lor de hidrogen..
În apa lichidă, moleculele sale au o libertate mai mare de mișcare decât în gheață, unde vibrează staționare în cristalele sale. Pentru a se deplasa, moleculele trebuie să absoarbă energia în așa fel încât vibrațiile lor să rupă legăturile puternice de hidrogen direcționale din gheață..
Din acest motiv gheața absoarbe căldura pentru a se topi. Pentru a exista „gheață fierbinte”, legăturile de hidrogen ar trebui să fie anormal de puternice pentru a se topi la o temperatură cu mult peste 0 ° C..
Indice articol
- 1 Caracteristicile unei reacții endotermice
- 1,1 ΔH> 0
- 1.2 Își răcoresc împrejurimile
- 2 ecuații
- 3 Exemple de reacții endoterme comune
- 3.1 Evaporarea gheții uscate
- 3.2 Coacerea pâinii sau prepararea alimentelor
- 3.3 Plajă
- 3.4 Reacția formării de azot atmosferic și ozon
- 3.5 Electroliza apei
- 3.6 Fotosinteza
- 3.7 Soluții ale unor săruri
- 3.8 Descompuneri termice
- 3.9 Clorură de amoniu în apă
- 3.10 Triosulfat de sodiu
- 3.11 Motoare auto
- 3.12 Lichide fierte
- 3.13 Gătirea unui ou
- 3.14 Gătirea alimentelor
- 3.15 Încălzirea alimentelor în cuptorul cu microunde
- 3.16 Turnarea sticlei
- 3.17 Consumul unei lumânări
- 3.18 Curățarea apei calde
- 3.19 Sterilizarea prin căldură a alimentelor și a altor obiecte
- 3.20 Combaterea infecțiilor cu febră
- 3.21 Evaporarea apei
- 4 Referințe
Caracteristicile unei reacții endotermice
Schimbarea de stare nu este în mod corespunzător o reacție chimică; totuși, același lucru se întâmplă: produsul (apa lichidă) are o energie mai mare decât reactantul (gheața). Aceasta este principala caracteristică a unei reacții endoterme sau a unui proces: produsele sunt mai energice decât reactanții.
Deși acest lucru este adevărat, nu înseamnă că produsele trebuie să fie neapărat instabile. În cazul în care este, reacția endotermică nu mai este spontană în toate condițiile de temperatură sau presiune..
Luați în considerare următoarea ecuație chimică:
A + Q => B
Unde Q reprezintă căldură, exprimată de obicei în unități de joule (J) sau calorii (cal). Deoarece A absoarbe căldura Q pentru a se transforma în B, atunci se spune că este o reacție endotermă. Astfel, B are mai multă energie decât A și trebuie să absoarbă suficientă energie pentru a-și realiza transformarea.
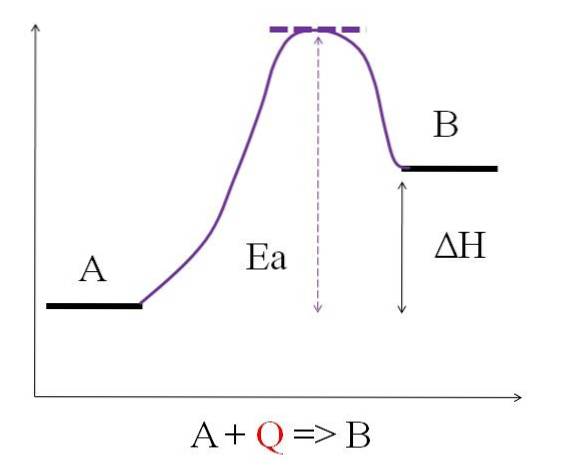
După cum se poate vedea în diagrama de mai sus, A are mai puțină energie decât B. Cantitatea de căldură Q absorbită de A este astfel încât depășește energia de activare (energia necesară pentru a atinge vârful purpuriu cu acoperișul punctat). Diferența de energie dintre A și B este cunoscută sub numele de entalpia reacției, ΔH.
ΔH> 0
Toate reacțiile endotermice au în comun diagrama de mai sus, deoarece produsele sunt mai energice decât reactanții. Prin urmare, diferența de energie dintre ele, ΔH, este întotdeauna pozitivă (HProdus-HReactiv > 0). Deoarece acest lucru este adevărat, trebuie să existe o absorbție de căldură sau energie din împrejurimi pentru a furniza această nevoie de energie..
Și cum sunt interpretate astfel de expresii? Într-o reacție chimică, legăturile sunt întotdeauna rupte pentru a crea altele noi. Pentru a le sparge, este necesară absorbția energiei; adică este un pas endoterm. Între timp, formarea legăturilor implică stabilitate, deci este un pas exoterm..
Când legăturile formate nu oferă stabilitate comparabilă cu cantitatea de energie necesară pentru ruperea vechilor legături, este o reacție endotermă. Acesta este motivul pentru care este nevoie de energie suplimentară pentru a promova ruperea celor mai stabile legături din reactanți..
Pe de altă parte, în reacțiile exoterme se întâmplă opusul: se eliberează căldură, iar ΔH este < 1 (negativo). Aquí los productos son más estables que los reactivos, y el diagrama entre A y B cambia de forma; ahora B se ubica por debajo de A, y la energía de activación es menor.
Își răcoresc împrejurimile
Deși nu se aplică tuturor reacțiilor endotermice, mai multe dintre ele determină o scădere a temperaturii din mediul înconjurător. Acest lucru se datorează faptului că căldura absorbită provine de undeva. În consecință, dacă conversia A și B ar fi efectuată într-un container, aceasta ar fi răcită.
Cu cât reacția este mai endotermă, cu atât containerul și împrejurimile sale vor deveni mai reci. De fapt, unele reacții sunt chiar capabile să formeze un strat subțire de gheață, de parcă ar fi ieșit dintr-un frigider..
Cu toate acestea, există reacții de acest tip care nu le răcoresc împrejurimile. De ce? Deoarece căldura din jur este insuficientă; adică nu oferă Q-ul necesar (J, cal) care este scris în ecuații chimice. Prin urmare, acesta este momentul în care intră focul sau radiațiile ultraviolete..
Poate apărea o mică confuzie între cele două scenarii. Pe de o parte, căldura din împrejurimi este suficientă pentru ca reacția să se desfășoare spontan și se observă răcirea; iar pe de altă parte, este nevoie de mai multă căldură și se folosește o metodă eficientă de încălzire. În ambele cazuri se întâmplă același lucru: energia este absorbită.
Ecuații
Care sunt ecuațiile relevante într-o reacție endotermică? După cum sa explicat deja, ΔH trebuie să fie pozitiv. Pentru a o calcula, este luată în considerare mai întâi următoarea ecuație chimică:
aA + bB => cC + dD
Unde A și B sunt reactanții, iar C și D sunt produsele. Literele minuscule (a, b, c și d) sunt coeficienții stoichiometrici. Pentru a calcula ΔH a acestei reacții generice, se aplică următoarea expresie matematică:
ΔHProduse- ΔHReactivi = ΔHrxn
Puteți continua direct sau puteți face calculele separat. Pentru ΔHProduse trebuie calculată următoarea sumă:
c ΔHFC + d ΔHFD
Unde ΔHF este entalpia de formare a fiecărei substanțe implicate în reacție. Prin convenție, substanțele în formele lor cele mai stabile au ΔHF= 0. De exemplu, moleculele de ODouă si HDouă, sau un metal solid, au ΔHF= 0.
Același calcul se face acum și pentru reactanți, ΔHReactivi:
a ΔHFA + b ΔHFB
Dar, din moment ce ecuația spune că ΔHReactivi trebuie scăzut din ΔHProduse, atunci suma de mai sus trebuie înmulțită cu -1. Deci tu ai:
c ΔHFC + d ΔHFD - (a ΔHFA + b ΔHFB)
Dacă rezultatul acestui calcul este un număr pozitiv, atunci este o reacție endotermă. Și dacă testează negativ, este o reacție exotermă.
Exemple de reacții endotermice obișnuite
Evaporarea gheții uscate

Oricine a văzut vreodată fumurile albe emanate dintr-un cărucior cu înghețată a fost martorul unuia dintre cele mai frecvente exemple de „reacție” endotermică..
Dincolo de unele înghețate, acești vapori degajați din solidele albe, numite gheață uscată, au făcut, de asemenea, parte din scenariile de creare a efectului de ceață. Această gheață uscată nu este altceva decât dioxid de carbon solid, care atunci când absoarbe temperatura și înainte ca presiunea externă să înceapă să se sublimeze.
Un experiment pentru un public de copii ar fi să umple și să sigileze o pungă cu gheață uscată. După un timp, se va umfla în cele din urmă datorită CODouă gazos, care generează muncă sau presează pereții interiori ai sacului împotriva presiunii atmosferice.
Coacerea pâinii sau prepararea alimentelor

Coacerea pâinii este un exemplu de reacție chimică, deoarece acum există modificări chimice datorate căldurii. Oricine a mirosit aroma pâinii proaspăt coapte știe că are loc o reacție endotermă.
Aluatul și toate ingredientele sale au nevoie de căldura cuptorului pentru a efectua toate transformările, esențiale pentru a deveni pâine și pentru a-și prezenta caracteristicile tipice..
Pe lângă pâine, bucătăria este plină de exemple de reacții endotermice. Cine gătește se ocupă zilnic de ei. Gătirea pastelor, înmuierea miezurilor, încălzirea miezurilor de porumb, gătirea ouălor, condimentarea cărnii, coacerea unui tort, prepararea ceaiului, încălzirea sandvișurilor; fiecare dintre aceste activități reprezintă reacții endotermice.
Bronzare

Oricât de simple și de comune ar părea, băile de soare luate de anumite reptile, precum broaștele țestoase și crocodilii, intră în categoria reacțiilor endoterme. Țestoasele absorb căldura de la soare pentru a-și regla temperatura corpului.
Fără soare, rețin căldura apei pentru a se încălzi; care se termină prin răcirea apei din iazurile sau tancurile de pește.
Reacția formării de azot atmosferic și ozon

Aerul este alcătuit în principal din azot și oxigen. În timpul furtunilor electrice, o astfel de energie este eliberată încât poate rupe legăturile puternice care țin atomii de azot laolaltă în molecula de NDouă:
NDouă + SAUDouă + Q => 2NO
Pe de altă parte, oxigenul poate absorbi radiațiile ultraviolete pentru a deveni ozon; alotrop de oxigen care este foarte benefic în stratosferă, dar dăunător vieții la nivelul solului. Reacția este:
3ODouă + v => 2O3
Unde v înseamnă radiație ultravioletă. Mecanismul din spatele acelei ecuații simple este foarte complex.
Electroliza apei
Electroliza folosește energia electrică pentru a separa o moleculă în elementele sau moleculele sale de formare. De exemplu, în electroliza apei, se generează două gaze: hidrogen și oxigen, fiecare în electrozi diferiți:
2HDouăO => 2HDouă + SAUDouă
De asemenea, clorura de sodiu poate suferi aceeași reacție:
2NaCl => 2Na + ClDouă
Într-un electrod veți vedea formarea de sodiu metalic, iar în celălalt, bule verzuie de clor.
Fotosinteză

Plantele și copacii trebuie să absoarbă lumina soarelui ca sursă de energie pentru a sintetiza biomaterialele lor. Pentru aceasta, folosește CO ca materie primă.Două și apa, care printr-o serie lungă de etape, sunt transformate în glucoză și alte zaharuri. În plus, se formează oxigen, care este eliberat din frunze.
Soluții ale unor săruri
Dacă clorura de sodiu este dizolvată în apă, nu va exista nicio modificare vizibilă a temperaturii exterioare a sticlei sau recipientului..
Unele săruri, cum ar fi clorura de calciu, CaClDouă, crește temperatura apei ca produs al hidratării mari a ionilor de Ca.Două+. Și alte săruri, cum ar fi azotatul sau clorura de amoniu, NH4NU3 și NH4Cl, scade temperatura apei și răcorește-i împrejurimile.
În săli de clasă, experimentele la domiciliu se fac de obicei prin dizolvarea unora dintre aceste săruri pentru a demonstra ce este o reacție endotermă..
Scăderea temperaturii se datorează hidratării ionilor NH4+ nu este favorizat împotriva dizolvării aranjamentelor cristaline ale sărurilor sale. În consecință, sărurile absorb căldura din apă pentru a permite solvatarea ionilor..
O altă reacție chimică care este de obicei foarte frecventă pentru a demonstra acest lucru este următoarea:
Ba (OH)Două8HDouăO + 2NH4NU3 => Ba (NR3)Două + 2NH3 +10HDouăSAU
Rețineți cantitatea de apă formată. Prin amestecarea ambelor solide, o soluție apoasă de Ba (NO3)Două, mirosind a amoniac și cu o scădere a temperaturii, astfel încât să înghețe literalmente suprafața exterioară a recipientului.
Descompuneri termice
Una dintre cele mai frecvente descompuneri termice este cea a bicarbonatului de sodiu, NaHCO3, pentru a produce CODouă și apă la încălzire. Multe solide, inclusiv carbonați, se descompun adesea pentru a elibera CODouă și oxidul corespunzător. De exemplu, descompunerea carbonatului de calciu este după cum urmează:
Hoţ3 + Q => CaO + CODouă
La fel se întâmplă și cu carbonații de magneziu, stronțiu și bariu.
Este important să rețineți că descompunerea termică este diferită de combustie. În prima nu există prezență de aprindere sau se eliberează căldură, în timp ce în a doua există; adică arderea este o reacție exotermă, chiar și atunci când are nevoie de o sursă inițială de căldură pentru a avea loc sau a se produce spontan.
Clorură de amoniu în apă
Când o cantitate mică de clorură de amoniu (NH4Cl) este dizolvată în apă într-o eprubetă, eprubeta devine mai rece decât înainte. În timpul acestei reacții chimice, căldura este absorbită din mediu.
Triosulfat de sodiu
Când cristalele de tiosulfat de sodiu (NaDouăSDouăSAU3.5HDouăO), numite în mod obișnuit sughiț, se dizolvă în apă, are loc un efect de răcire.
Motoare auto
Arderea benzinei sau motorinei la motoarele autoturismelor, camioanelor, tractoarelor sau autobuzelor produce energie mecanică, care este utilizată în circulația acestor vehicule.
Lichide fierte
Prin încălzirea unui lichid, acesta câștigă energie și intră într-o stare gazoasă.
Gatiti un ou
Când se aplică căldură, proteinele din ouă sunt denaturate, formând structura solidă care este de obicei ingerată..
Gătit alimente
În general, întotdeauna când gătiți cu căldură pentru a schimba proprietățile alimentelor, apar reacții endoterme.
Aceste reacții sunt cele care determină hrana să devină mai moale, generează mase maleabile, eliberează componentele pe care le conțin, printre altele..
Încălzirea alimentelor în cuptorul cu microunde
Prin radiația cu microunde, moleculele de apă din alimente absorb energia, încep să vibreze și cresc temperatura alimentelor.
Turnarea sticlei
Absorbția căldurii de către sticlă face ca îmbinările să fie flexibile, facilitând schimbarea formei sale.
Consumul unei lumânări
Ceara lumânării se topește absorbind căldura din flacără, schimbându-i forma.
Curatarea apei calde
Atunci când utilizați apă fierbinte pentru a curăța obiectele care au fost pătate cu grăsime, precum vase sau haine, grăsimea devine mai lichidă și este mai ușor de îndepărtat.
Sterilizarea termică a alimentelor și a altor obiecte
La încălzirea obiectelor sau a alimentelor, și microorganismele pe care le conțin își cresc temperatura.
Când este furnizată multă căldură, apar reacții în celulele microbiene. Multe dintre aceste reacții, cum ar fi ruperea legăturilor sau denaturarea proteinelor, ajung să distrugă microorganismele.
Combate infecțiile cu febră
Când apare febra, acest lucru se datorează faptului că organismul produce căldura necesară pentru a ucide bacteriile și virusurile care provoacă infecții și generează boli..
Dacă căldura generată este multă și febra este mare, celulele corpului sunt de asemenea afectate și există riscul de deces.
Evaporarea apei
Când apa se evaporă și se transformă în abur, aceasta se datorează căldurii pe care o primește din mediu. Pe măsură ce energia termică este primită de fiecare moleculă de apă, energia vibrației sale crește până la punctul în care se poate mișca liber, creând abur..
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Wikipedia. (2018). Proces endotermic. Recuperat de pe: en.wikipedia.org
- Helmenstine, Anne Marie, dr. (27 decembrie 2018). Exemple de reacții endotermice. Recuperat de pe: thoughtco.com
- Academia Khan. (2019). Endotermică vs. reacții exoterme. Recuperat de pe: khanacademy.org
- Serm Murmson. (2019). Ce se întâmplă la nivel molecular în timpul unei reacții endotermice? Hearst Seattle Media. Recuperat de pe: education.seattlepi.com
- QuimiTube. (2013). Calculul entalpiei de reacție din entalpiile de formare. Recuperat de pe: quimitube.com
- Quimicas.net (2018). Exemple de reacție endotermică. Recuperat din:
chimie.net.



Nimeni nu a comentat acest articol încă.