
Reactivul lui Benedict pentru ce este, componente, pregătire
Reactivul lui Benedict este o soluție albăstruie de cupru care este utilizată pentru a detecta prezența zaharurilor reducătoare: aldehide, alfa-hidroxi-cetone și hemicetale. A fost dezvoltat de Stanley R. Benedict (1884-1936).
Zaharurile alfa-hidroxi-cetone se caracterizează prin faptul că au o grupare hidroxil în vecinătatea cetonei. Între timp, un hemicetal este un compus care rezultă din adăugarea unui alcool la o aldehidă sau cetonă. Reactivul lui Benedict reacționează fără discriminare cu toate aceste zaharuri reducătoare.
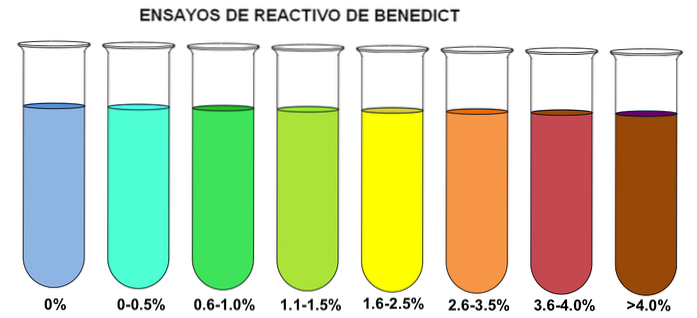
Metoda lui Benedict se bazează pe acțiunea de reducere a zaharurilor asupra CuDouă+, de culoare albastră, care îl transformă în Cu+. CU+ formează un precipitat roșu de cărămidă de oxid cupros. Cu toate acestea, în funcție de concentrația de zaharuri, apare un spectru de culori (imaginea superioară).
Rețineți că, dacă reactivul Benedict este adăugat într-o eprubetă fără reducerea zaharurilor (0%), nu suferă nicio modificare a culorii sale albăstrui. Astfel, atunci când concentrația este mai mare de 4%, eprubeta este colorată în maro..
Indice articol
- 1 Istorie
- 2 Pentru ce este reactivul lui Benedict?
- 2.1 Detectarea glucozei în urină
- 2.2 Colorarea soluției
- 2.3 Detectarea diferitelor monozaharide și dizaharide
- 3 componente
- 4 Procedura de utilizare
- 5 Reacția testului lui Benedict
- 6 Pregătirea reactivului lui Benedict
- 7 Referințe
Poveste
Reactivul a fost creat de chimistul american Stanley Rossiter Benedict în 1909, care și-a publicat lucrarea științifică Un reactiv pentru detectarea zaharurilor reducătoare, în revista J. Biol. Chem.
Mai mult, Lewis și Benedict (1915) au publicat o metodă de determinare a reducerii zaharurilor din sânge, folosind picrat ca indicator; dar a încetat să fie folosit din cauza lipsei de specificitate.
Reactivul lui Benedict este foarte asemănător cu cel al lui Fehling. Ele diferă prin faptul că Benedict folosește ionul citrat și sarea carbonat de sodiu; în timp ce Fehling folosește ionul tartrat și hidroxidul de sodiu.
Testul Benedict este calitativ, adică detectează doar prezența zaharurilor reducătoare. Cu toate acestea, reactivul lui Benedict poate fi cantitativ dacă are tiocianat de potasiu în soluție, care formează un precipitat alb de tiocianat de cupru care poate fi titrat utilizând standarde de glucoză..
Pentru ce este reactivul lui Benedict?
Detectarea glucozei în urină
Reactivul Benedict este încă utilizat pentru a detecta prezența glucozei în urină și este o indicație a bolii diabetului la pacient, a cărui urină este supusă testului sau testului Benedict. Deși nu se poate exclude faptul că glucozuria are o origine diferită.
De exemplu, glicozuria crescută se găsește în condiții precum: sarcină, glicozurie renală primară, acidoză tubulară renală, sindrom Fanconi primar sau secundar, hiperaldosteronism și pancreatită acută sau cancer pancreatic..
Reactivul lui Benedict este albastru datorită prezenței CuDouă+, care se reduce la Cu+ prin acțiunea de reducere a zaharurilor; în acest caz, glucoza, formând un precipitat de oxid de cupru (I) roșu-cărămidă.
Colorarea soluției
Culoarea și formarea precipitatului în testul Benedict aplicat în urină variază în funcție de concentrația zahărului reducător. Dacă concentrația de glucoză în urină este mai mică de 500 mg / dL, soluția devine verde și nu există formare de precipitate.
O concentrație de glucoză în urină de 500 - 1.000 mg / dl provoacă un precipitat verde în testul Benedict. La o concentrație mai mare de 1.000 până la 1.500 mg / dl, provoacă formarea unui precipitat galben.
Dacă concentrația de glucoză este de 1.500 - 2.000 mg / dL, se va vedea un precipitat portocaliu. În cele din urmă, o concentrație de glucoză în urină este mai mare de 2.000 mg / dL, va provoca formarea unui precipitat roșu de cărămidă..
Acest lucru indică faptul că testul Benedict are un caracter semicantitativ și rezultatul este raportat folosind cruci. Astfel, de exemplu, formarea unui precipitat verde corespunde unei cruci (+); și formarea unui precipitat roșu de cărămidă, corespunde a patru cruci (++++).
Detectarea diferitelor monozaharide și dizaharide
Reactivul lui Benedict detectează prezența zaharurilor reducătoare care au o grupă funcțională liberă sau o grupă funcțională cetonică liberă, ca parte a structurii lor moleculare. Acesta este cazul glucozei, galactozei, manozei și fructozei (monozaharide), precum și lactozei și maltozei (dizaharidelor).
Zaharoza și amidonul nu reacționează cu reactivul lui Benedict, deoarece au grupuri reducătoare libere. În plus, există compuși care interferează cu testul Benedict în urină, dând falsă pozitivitate; acesta este cazul salicilatului, penicilinei, streptomicinei, levodopa, acidului nalidixic și izoniazidei.
Există substanțe chimice prezente în urină care pot reduce reacția Benedictului; de exemplu: creatinină, urat și acid ascorbic.
Componente (editați)
Componentele reactivului Benedict sunt următoarele: sulfat de cupru pentahidrat, carbonat de sodiu, citrat trisodic și apă distilată..
Sulfat de cupru pentahidrat, CuSO45HDouăO, conține CuDouă+: este compusul care conferă reactivului lui Benedict culoarea albastră. Zaharurile reducătoare acționează asupra CuDouă+, producând reducerea acestuia la Cu+ și formarea unui precipitat de oxid cupros (CuDouăO) roșu cărămidă.
Carbonatul de sodiu generează un mediu alcalin, necesar pentru reducerea cuprului. Carbonatul de sodiu reacționează cu apa, generând bicarbonat de sodiu și ionul hidroxil, OH-, responsabil pentru alcalinitatea mediului necesar procesului reductiv.
Citratul de sodiu formează un complex cu cuprul (II) care îl împiedică să sufere o reducere la Cu (I) în timpul depozitării.
Procedura de utilizare
5 ml de reactiv Benedict sunt plasate într-o eprubetă de 20 x 160 mm și se adaugă 8 picături de urină. Eprubeta este agitată ușor și plasată într-un recipient cu apă clocotită timp de 5-10 minute..
După acest timp, tubul este scos din baia de apă fierbinte și suprafața acestuia este răcită cu apă curentă pentru a avea în cele din urmă citirea rezultatului obținut la efectuarea testului Benedict (culorile).
Reacția de testare a lui Benedict
Reducerea Cu (II) în timpul testului Benedict poate fi evidențiată după cum urmează:
RCHO + 2 CuDouă+ (în complex) + 5 OH- => RCOO- + CuDouăO + 3 HDouăSAU
RCHO = aldehidă; RCOO- = (ion carboxilat); CuDouăO = oxid cupros, un precipitat roșu de cărămidă.
Pregătirea reactivului lui Benedict
173 grame de citrat de sodiu și 100 de grame de carbonat de sodiu sunt cântărite și dizolvate împreună în 800 mL de apă caldă distilată. Dacă se observă urme de substanțe nedizolvate, soluția trebuie filtrată.
Pe de altă parte, 17,3 grame de sulfat cupric pentahidrat sunt dizolvate în 100 ml de apă distilată..
Ulterior, cele două soluții apoase sunt ușor amestecate și continuate cu agitare permanentă, ajungând la 1.000 mL cu apă distilată..
Referințe
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (10a ediție.). Wiley plus.
- Clark J. (2015). Oxidarea aldehidelor și cetonelor. Recuperat de pe: chemguide.co.uk
- Wikipedia. (2020). Reactivul lui Benedict. Recuperat de pe: en.wikipedia.org
- Echipa editorială. (9 ianuarie 2019). Testul lui Benedict: Principiu, pregătire reactivă, procedură și interpretare. Recuperat de pe: laboratorinfo.com
- Dr. Whitson. (s.f.). Reactivul lui Benedict: un test pentru reducerea zaharurilor. Recuperat de la: nku.edu


Nimeni nu a comentat acest articol încă.