
Selectați caracteristicile, tipurile și funcția
selectins Sunt o familie de glicoproteine formate din lanțuri polipeptidice, care recunosc conformații specifice ale zaharurilor (glucidelor), situate pe suprafața altor celule și se leagă de ele. Din acest motiv, ele sunt numite și molecule de adeziune..
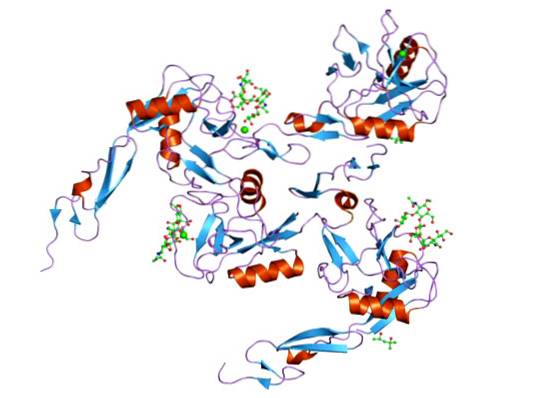
Acești receptori de aderență sunt cunoscuți pentru structura lor conservată. Au trei domenii și trei glicoproteine diferite. Ele pot fi exprimate ca molecule de suprafață, pe lângă faptul că sunt stocate sau funcționează ca molecule solubile.

Spre deosebire de alte molecule de adeziune, selectinele acționează numai asupra interacțiunilor celulelor albe din sânge cu endoteliul vascular.
Indice articol
- 1 Caracteristici
- 2 tipuri
- 2.1 L-selectin
- 2.2 P-selectin
- 2.3 E-selectin
- 3 Funcția
- 4 Referințe
Caracteristici
Selectinele sunt proteine care conțin oligozaharide în lanț, legate covalent de lanțurile laterale de aminoacizi (glicoproteine). Sunt molecule transmembranare, ceea ce înseamnă că traversează bistratul lipidic al celulei, fie într-o singură etapă (o etapă), fie în mai multe etape (cu mai multe etape)..
Acestea împărtășesc caracteristici care sunt foarte asemănătoare cu proteinele CLEC sau lectinele de tip C. Deoarece, la fel ca lectinele de tip C, selectinele necesită ioni de calciu pentru legare..
Originea cuvântului „selectin” se referă la faptul că aceste proteine sunt exprimate selectiv în celulele sistemului vascular și conțin, de asemenea, un domeniu de lectină.
Unii autori includ selectine (glicoproteine) în lectine, deoarece sunt molecule care se leagă de zaharuri. Cu toate acestea, alți autori le diferențiază sub conceptul că lectinele recunosc doar carbohidrații și se leagă de acestea, în timp ce selectinele nu numai că recunosc și leagă zaharurile, dar sunt formate și din carbohidrați.
Reglarea selectinelor are loc la nivel transcripțional, prin prelucrare proteolitică, prin clasificare celulară și prin expresii reglate ale glicozil-transferazelor..
Selectinele au un domeniu intracelular scurt. Cu toate acestea, ele au trei domenii extracelulare, un domeniu de tip factor de creștere epidermic, un domeniu de tip C de lectină și unități de repetare consens, similare cu proteinele de reglare complementare..
Tipuri
Familia selectinelor este formată din trei tipuri diferite de glicoproteine. Fiecare dintre acestea este identificată cu o scrisoare care denotă locul în care au fost identificate pentru prima dată. În continuare îi vom vedea pe fiecare dintre ei.
L-selectin
Este, de asemenea, cunoscut sub numele de SELL, CD62L, LAM1, LEU8, LNHR, LSEL sau TQ1. Se găsește în leucocite, de unde și „L” pentru L-selectină. Este o componentă a suprafeței celulare. Cele trei domenii sunt: un homolog de lectină, un factor de creștere epidermică și două unități de repetare consens..
Are mai mulți liganzi, adică, în general, molecule mici, care formează complexe cu o biomoleculă, în acest caz o proteină. Liganzii cunoscuți pentru L-selectină sunt după cum urmează.
GLYCAM1
Cunoscut sub numele de moleculă de adeziune celulară dependentă de glicozilare -1, este un ligand proteoglican care se exprimă în inflamații venoase post-capilare și permite limfocitelor să iasă din fluxul sanguin în țesuturile limfoide..
CD34
Este o fosfoglicoproteină, detectată în diferite grupuri de mamifere, cum ar fi omul, șobolanii și șoarecii, printre altele. A fost descris pentru prima dată în celulele stem hematopoietice. Acestea se găsesc într-o mare varietate de celule, dar sunt aproape exclusiv legate de celulele hematopoietice.
MAdCAM-1
Cunoscută sub numele de Adresin sau moleculă de adeziune celulară în direcția mucoasei vasculare (în limba engleză, mucosal vascular addressin cell adhesion molecule 1). Este o proteină extracelulară a endoteliului care este responsabilă de determinarea în ce țesut vor intra limfocitele, pe lângă transportarea zaharurilor, astfel încât acestea să fie recunoscute de L-selectină.
PSGL-1
Cunoscută printre alte sinonime ca SELPLG sau CD162, este o glicoproteină care se găsește în celulele endoteliale și leucocite. Se poate lega de celelalte două tipuri de selectine. Cu toate acestea, se pare că are o afinitate mai bună pentru P-selectină..
P-selectin
P-selectina este cunoscută sub alte nume precum SELP, CD62, CD62P, GMP140, GRMP sau LECAM3, printre altele. Se găsește la suprafața celulelor endoteliale, care acoperă marginile interioare ale vaselor de sânge și ale trombocitelor..
P-selectina a fost identificată pentru prima dată în trombocite. De aceea, numele proteinei poartă „P” inițial.
Structura P-selectinei constă dintr-un domeniu foarte similar cu lectina de tip C la capătul N-terminal, un domeniu asemănător EGF; adică, un domeniu proteic conservat de aproximativ 30 până la 40 de resturi de aminoacizi, cu o foaie β dublu-catenară urmată de o buclă la o foaie β scurt-C dublă cu catenă.
Are un al treilea domeniu similar proteinelor care leagă complementul, numit domeniu CUB, care se caracterizează prin faptul că este un domeniu proteic conservat evolutiv și prin prezentarea a aproximativ 110 reziduuri de aminoacizi.
Ligandul cu cea mai mare afinitate pentru P-selectină este PSGL-1, așa cum s-a descris anterior în liganzii pentru L-selectină. Pe de altă parte, această proteină poate forma, de asemenea, complexe cu alte molecule, cum ar fi polizaharida sulfatată numită fucoidan și heparan sulfat..
E-selectin
Această proteină selectină este, de asemenea, cunoscută sub următoarele nume: SELE, CD62E, ELAM, ELAM1, ESEL, LECAM2 și altele. Se exprimă exclusiv în celulele endoteliale care sunt activate de proteine mici care nu sunt capabile să traverseze stratul bicomponent lipidic al celulei, numite citokine..
Structura acestei proteine este formată din 3 domenii (ca și restul selectinelor): un domeniu asemănător EGF, 6 unități de module de proteine de control repetate SCR (numite și domenii sushi) și un domeniu transmembranar..
Liganzii care formează complexe cu selectivele E sunt destul de variate, dar cele care se remarcă sunt următoarele.
Sialyl-Lewis A.
Numit și SLe A sau CA19-9. Este o tetrazaharidă descoperită în seruri de la pacienții cu cancer. Se știe că participă la procesul de recunoaștere celulă-celulă. Este exprimat constitutiv în granulocite, monocite și limfocite T..
Sialyl-Lewis X
Este, de asemenea, un tetratazaharid ca Sialyl-Lewis A și are funcții similare. Se exprimă în granulocite și monocite și controlează scurgerea nedorită sau scurgerea acestor celule în timpul inflamației..
PSGL-1
Deși este aparent mai eficient la P-selectină, unii autori consideră că forma derivată a neutrofilului uman este, de asemenea, destul de eficientă la E-selectină. De fapt, ei consideră că, în general, acest ligand este esențial pentru cele trei tipuri de selectine..
Funcţie
Funcția principală a selectinelor este de a face parte din procesul de formare a celulelor albe din sânge (limfocite). De asemenea, participă la răspunsul imun, la inflamațiile cronice și acute în diferite organe ale corpului, cum ar fi rinichii, inima și pielea. Aceștia acționează chiar și în procesele inflamatorii ale metastazei cancerului.
Referințe
- Selectează. Recuperat de pe: en.wikipedia.org.
- L-selectin. Recuperat de pe: en.wikipedia.org.
- CA19-9. Recuperat de pe: en.wikipedia.org.
- E-selectin. Recuperat de pe: en.wikipedia.org.
- X. Zou, V.R. Shinde Patil, N.M. Dagia, L.A. Smith, M.J. Wargo, K.A. Interliggi, C.M. Lloyd, D.F. Tees, B. Walcheck, M.B. Lawrence, D.J. Goetz (2005). PSGL-1 derivat din neutrofile umane este un ligand de înaltă eficiență pentru E-selectină exprimată de endoteliu sub flux. Revista Americană de Fiziologie. Fiziologie celulară.
- K. Law (2001). Funcțiile selectinelor. Rezultate și probleme în diferențierea celulară.
- Selectins. Recuperat de la: wellpath.uniovi.es.
- J.H. Pérez și C.J. Montoya. Molecule de adeziune. Recuperat de pe: encolombia.com.
- A.C. Sanguineti & J.M Rodríguez-Tafur (1999). Aderența și moleculele pielii. Dermatologie peruană.
- T.F. Tedder, D.A. Steeber, A. Chen, P. Engel (1995). Selectinele: molecule de adeziune vasculară. Jurnalul FASEB.


Nimeni nu a comentat acest articol încă.