
Seria spectrală
serie spectrală Acestea constau dintr-un set de linii colorate pe un fundal întunecat sau din dungi strălucitoare separate de zone întunecate care emit lumină din tot felul de substanțe..
Aceste linii sunt vizualizate cu ajutorul unui spectrometru, a unui aparat care constă dintr-o prismă sau o rețea fin divizată, capabilă să separe diferitele componente ale luminii..
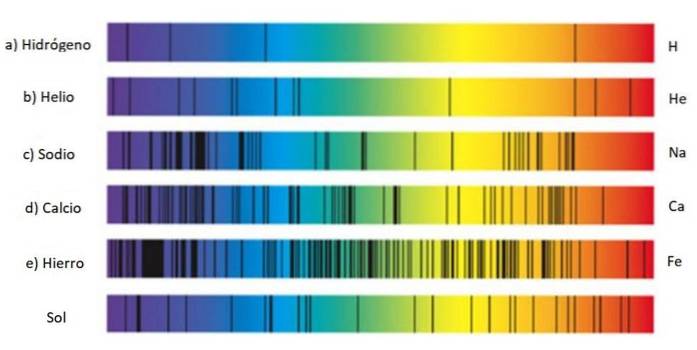
Aceste seturi de linii sunt numite spectru și fiecare substanță are un spectru caracteristic, un fel de amprentă care servește la identificarea prezenței sale în lumina care provine dintr-un obiect. Acest lucru se datorează faptului că fiecare atom are propria configurație electronică și nivelurile de energie permise..
De aceea, găsirea liniilor spectrale este o tehnică utilizată pe scară largă de astronomi pentru a afla compoziția stelelor prin lumina pe care o emit. De fapt, tot ce știu astronomii despre stele provine din spectrele lor, fie că este vorba de emisie sau absorbție..
Originea spectrelor
Prezența spectrelor se datorează configurației atomice. De fapt, electronii sunt ținuți în jurul nucleului în regiunile numite orbitali, situat la distanțe discrete de el.
De exemplu în hidrogen, cel mai simplu element, razele orbitale sunt date de 0,053 ∙ nDouă nanometri, unde n = 1, 2, 3, 4,…. Valorile intermediare dintre acestea nu sunt permise, de aceea se spune că orbitalele sunt cuantificat. De asemenea, starea energetică a fiecărui orbital este cuantificată.
Astfel de restricții determină electronii să se comporte atât ca particule, cât și ca unde, la fel ca lumina. Cu toate acestea, electronii pot trece de la un orbital la altul, schimbând starea de energie a atomului..
Absorbție și emisie de energie electromagnetică
De exemplu, dacă un electron trece de la un orbital mai intern, cu energie mai mică, la unul mai extern și energetic, este necesar ca acesta să dobândească energia electromagnetică necesară, care este stocată în atom. Acest proces se numește absorbţie.
Pe de altă parte, dacă electronul trece de la un orbital exterior la unul mai interior, un foton este emis în tranziție, sub formă de lumină, care este energia corespunzătoare diferenței de energie dintre orbitali. Lungimea de undă corespunde acestei diferențe și este dată de:

- E este energie
- λ este lungimea de undă
- h este constanta lui Planck
- c este viteza luminii
Tipuri de spectre
Se produc atât spectre de absorbție, cât și emisii, care depind de anumiți parametri ai obiectului sau substanței, cum ar fi densitatea și temperatura. Spectrul unui gaz subțire este diferit de cel al unui solid la temperatură ridicată.
Spectru continuu
Unele surse emit spectre ale căror linii colorate se modifică ușor și conțin toate culorile. Acesta se numește spectru continuu, de exemplu cel produs de filamentul unui bec incandescent.
Spectrul de emisie
Este cea pe care o emit anumite substanțe fierbinți și constă din câteva linii de o anumită lungime de undă.
Acest tip de spectru este produs de gaze fierbinți, subțiri, precum cele care umplu tuburile fluorescente. Aurora boreală este un alt exemplu de emisie care apare în gazele din atmosfera superioară a Pământului. Unii nori de gaze interstelare produc, de asemenea, spectre de emisie..
Spectru de absorbție
Acest spectru este ceea ce se primește când lumina dintr-un obiect foarte fierbinte și dens este trecută printr-un gaz mai rece. În el, se observă aproape toate culorile, dar unele apar diminuate și franjuri întunecate apar în acele lungimi de undă care sunt absorbite de atomii sau moleculele gazului..
Legile spectroscopiei lui Kirchoff
Legile spectroscopiei lui Kirchoff indică în ce condiții se formează diferitele spectre descrise mai sus:
- Spectre continue: sunt emise de orice obiect la presiune și temperatură ridicate.
- Spectre de emisie: sunt produse de un gaz fierbinte la presiune scăzută, care emite linii în lungimi de undă bine definite, corespunzătoare tranzițiilor electronice corespunzătoare fiecărui element care alcătuiește gazul.
- Spectre de absorbție: sunt produse de gaze la temperaturi scăzute situate în apropierea surselor de radiații continue. Atomii sau moleculele de gaz absorb doar anumite lungimi de undă.
Spectrul de emisie al hidrogenului
Spectrul de emisie al hidrogenului este deosebit de important, deoarece este cel mai abundent element din întregul univers și conține o mulțime de informații importante despre stele și Calea Lactee..
Seria de linii din spectrul hidrogenului a fost descoperită de diverși cercetători și fiecare își poartă numele.
Seria Balmer
Hidrogenul emite mai multe linii în spectrul vizibil: atunci când electronul se descompune de la orbitalul 3 la orbitalul 2 emite lumină roșie, a cărei lungime de undă este 656,6 nm, iar dacă se descompune de la orbitalul 4 la orbitalul 2 atunci emite lumină albastră de 486,1 nm.

În 1885 (înainte ca Bohr să-și propună teoria), matematicianul și profesorul elvețian Johann Balmer (1825-1898) a găsit prin încercare și eroare o formulă pentru a determina lungimile de undă λ ale acestor linii:

Unde:
- R este constanta Rydberg: 1,097 × 107 m-1
- n = 3, 4, 5 ...., adică n ≥ 3 (întreg).
De exemplu, pentru n = 3 în ecuația lui Balmer:

Corespunzător liniei roșii din dreapta, prezentată în figura de mai sus. Descoperirea seriei Balmer i-a determinat pe alți oameni de știință să caute linii în restul spectrului pentru hidrogen și alte gaze..
Seria Lyman
Rețineți că spectrul de hidrogen prezentat în figură conține linii ultraviolete, cele două din extrema stângă, ale căror lungimi de undă sunt 397,0 nm și 388,9 nm. nm.
Într-adevăr, aceste linii ultraviolete corespund așa-numitei serii Lyman, descoperită în 1906 de fizicianul Theodore Lyman. Formula sa este:

Seria Paschen
Seria Paschen a fost descoperită de fizicianul german Friederich Paschen în 1908 și este valabilă pentru n ≥ 4, adică: n = 4, 5, 6 ...

Liniile lui Paschen se află în regiunea infraroșu apropiat și nivelul final este n = 3, adică valorile lor apar atunci când electronul se descompune de la niveluri superioare la n = 3. Deoarece seria Lyman se află în ultraviolet, se concluzionează că seria lui Balmer se află între Lyman și Paschen.
Seria Brackett
Această serie, descoperită în 1922 de Frederick Brackett, un fizician american, este situată în infraroșul îndepărtat și constă din liniile spectrale corespunzătoare tranzițiilor de hidrogen începând de la n = 5 și continuând:

Seria Pfund
Seria Pfund a fost găsită în 1924 de către fizicianul nord-american August Hermann Pfund și se referă la tranzițiile care încep de la n = 5, în banda infraroșie îndepărtată:

- Arny, T. 2017. Explorări: o introducere în astronomie. A 8-a. Ed. McGraw Hill.
- Bauer, W. 2011. Fizică pentru inginerie și științe. Volumul 2. Mc Graw Hill.
- Chang, R. 2013. Chimie. 11. Ediție. Mc Graw Hill Educație.
- Sears, Zemansky. 2016. Fizică universitară cu fizică modernă. 14. Ed. Volumul 2. Pearson.
- Ferestrele se deschid către univers. Diferitele clase de spectre. Recuperat de la: media4.obspm.fr.


Nimeni nu a comentat acest articol încă.