
Concept, proces și exemple de sublimare progresivă

sublimare progresivă Este un proces termodinamic în care o schimbare de stare endotermă are loc direct de la un solid la un gaz, fără formarea prealabilă a lichidului. Comportamentul solidului în condiții normale este încălzirea și topirea; adică să fuzioneze. Între timp, în sublimare, solidul începe să fumeze direct, fără apariția anterioară a picăturilor care indică topirea sa..
Ceea ce este descris în paragraful de mai sus este reprezentat în imaginea de mai sus. Să presupunem un amestec solid portocaliu (stânga), care începe să se încălzească. Amestecul este format din două componente sau solide: unul galben și celălalt roșu, a căror combinație are ca rezultat culoarea portocalie..
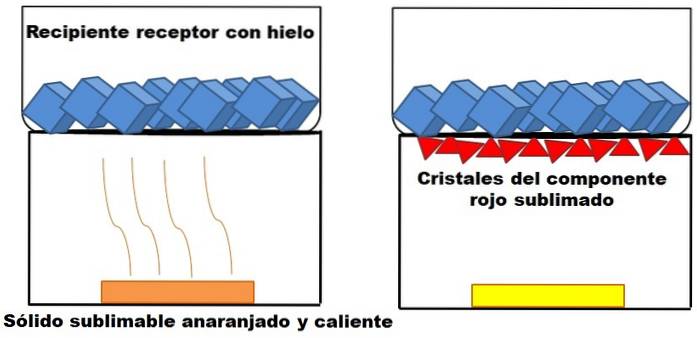
Solidul roșu se sublimează, deoarece un lichid nu se formează din el, ci ajunge să fie depus (triunghiuri roșii) la baza containerului superior; cel care conține cuburi de gheață și, prin urmare, oferă o suprafață rece. Între timp, solidul galben rămâne neschimbat de căldură (dreptunghi galben).
Triunghiurile sau cristalele roșii se depun datorită suprafeței reci a recipientului receptor (dreapta), care le absoarbe temperatura; Și chiar dacă nu este afișat, dimensiunea cuburilor de gheață ar trebui să scadă datorită absorbției căldurii. Solidul galben nu este sublimabil și, dacă îl încălziți mai devreme sau mai târziu, acesta se va topi.
Indice articol
- 1 Concept de sublimare progresivă
- 1.1 Proces
- 1.2 De la structura solidă la tulburarea gazoasă
- 1.3 Diagrama fazelor și punctul triplu
- 1.4 Condiții
- 2 Exemple
- 2.1 Purificarea solidelor
- 2.2 Sinteza cristalelor
- 3 Referințe
Concept de sublimare progresivă
Proces
S-a spus deja că sublimarea este o schimbare de stare endotermă, pentru că pentru a avea loc trebuie să existe o absorbție a căldurii. Dacă solidul absoarbe căldura, energia sa va crește, deci particulele sale vor vibra și la frecvențe mai mari..
Când aceste vibrații devin foarte puternice, ajung să afecteze interacțiunile intermoleculare (nu legăturile covalente); și, în consecință, mai devreme sau mai târziu particulele vor lua mai multe distanțe între ele, până când vor reuși să curgă și să se deplaseze mai liber prin regiunile spațiului.
În unele solide vibrațiile sunt atât de puternice încât unele particule „trag” din structură în loc să se aglomereze în grupuri în mișcare care definesc o picătură. Aceste particule scapă și formează prima „bulă”, care ar forma mai degrabă primii vapori ai solidului sublimat..
Vorbim atunci nu despre un punct de topire, ci despre un punct de sublimare. Deși ambele sunt dependente de presiunea care prevalează asupra solidului, punctul de sublimare este mai mult; prin urmare, temperatura sa variază remarcabil odată cu modificările presiunii (la fel ca și punctul de fierbere).
De la structura solidă la tulburarea gazoasă
În sublimare se mai spune că există o creștere a entropiei sistemului. Stările de energie ale particulelor trec de la a fi limitate de pozițiile lor fixe în structura solidă, la omogenizarea în direcțiile lor capricioase și haotice în stare gazoasă, mai uniformă, unde dobândesc în cele din urmă o energie cinetică medie..
Diagrama fazelor și punctul triplu
Punctul de sublimare depinde de presiune; pentru că altfel, particulele solide ar absorbi căldura nu pentru a trage în spațiu în afara solidului, ci pentru a forma picături. Nu s-ar sublima, dar s-ar topi sau topi, așa cum este cel mai obișnuit.
Cu cât este mai mare presiunea externă, cu atât este mai puțin probabilă sublimarea, deoarece solidul este forțat să se topească.
Dar ce solide sunt sublimabile și care nu? Răspunsul stă în diagramele de fază P vs T, precum cea prezentată mai jos:
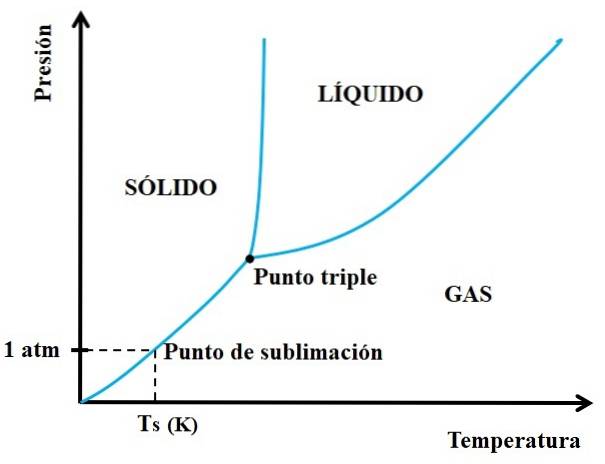
Mai întâi trebuie să ne uităm la punctul triplu și să parcurgem secțiunea inferioară: cea care separă stările solide și gazoase. Rețineți că, în regiunea solidului, trebuie să existe o scădere a presiunii pentru ca sublimarea să aibă loc (nu neapărat la 1 atm, presiunea noastră atmosferică). La 1 atm, substanța ipotetică se va sublima la o temperatură Ts exprimată în K.
Cu cât secțiunea sau curba mai lungă și orizontală sub punctul triplu, cu atât este mai mare capacitatea solidului de a sublima la diferite temperaturi; dar dacă este cu mult sub 1 atm, atunci vor fi necesare aspiratoare ridicate pentru a realiza sublimarea, în așa fel încât presiunile să fie reduse (0,0001 atm, de exemplu).
Termeni
Dacă punctul triplu este de mii de ori mai mic decât presiunea atmosferică, solidul nu se va sublima niciodată chiar și atunci când se aplică ultra-vid (ca să nu mai vorbim de susceptibilitatea sa la descompunere prin acțiunea căldurii).
Dacă nu este cazul, sublimările sunt efectuate prin încălzirea moderată și supunerea solidului la vid, astfel încât particulele sale să scape mai ușor, fără a fi nevoie ca acestea să absoarbă atât de multă căldură..
Sublimarea devine foarte importantă atunci când este vorba în special de solide cu o presiune de vapori ridicată; adică presiunea din interior, o reflectare a eficienței interacțiunilor lor. Cu cât presiunea sa de vapori este mai mare, cu atât este mai parfumată și cu atât este mai sublimabilă..
Exemple
Purificarea solidelor
Imaginea solidului portocaliu și a componentei sale roșiatice sublimabile este un exemplu al ceea ce reprezintă sublimarea în ceea ce privește purificarea solidelor. Triunghiurile roșii pot fi re-sublimate după cum este necesar până când se garantează o puritate ridicată.
Această tehnică este utilizată mai ales cu solide parfumate. De exemplu: camfor, cofeină, benzoină și mentol.
Printre alte solide care pot fi sublimate avem: iod, gheață (la altitudini mari), teobromină (din ciocolată), zaharină, morfină și alte medicamente, baze azotate și antracen.
Sinteza cristalelor
Revenind la triunghiurile roșii, sublimarea oferă o alternativă la cristalizarea convențională; Cristalele nu vor mai fi sintetizate dintr-o soluție, ci prin depunerea cât mai controlată posibilă a vaporilor pe o suprafață rece, unde pot exista convenabil semințe cristaline pentru a favoriza o morfologie specifică.
Spuneți, dacă aveți pătrate roșii, creșterea cristalului va păstra această geometrie și nu ar trebui să devină triunghiulare. Pătratele roșii vor crește treptat pe măsură ce are loc sublimarea. Cu toate acestea, este un complex operațional și molecular complex, în care sunt implicate multe variabile..
Exemple de cristale sintetizate prin sublimare sunt: carbură de siliciu (SiC), grafit, arsenic, seleniu, fosfor, nitrură de aluminiu (AlN), sulfură de cadmiu (CdS), selenură de zinc (ZnSe), iodură de mercur (HgI).Două), grafen, printre altele.
Rețineți că acestea sunt într-adevăr două fenomene împletite: sublimarea progresivă și depunerea (sau sublimarea inversă); vaporii migrează de la solid la regiuni sau suprafețe mai reci, stabilindu-se în cele din urmă sub formă de cristale.
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Wikipedia. (2019). Sublimare (tranziție de fază). Recuperat de pe: en.wikipedia.org
- Jones, Andrew Zimmerman. (27 ianuarie 2019). Sublimarea. Recuperat de pe: thoughtco.com
- Sheila Morrissey. (2019). Ce este sublimarea în chimie? - Definiție, proces și exemple. Studiu. Recuperat de la: study.com
- Elsevier B.V. (2019). Metoda sublimării. ScienceDirect. Recuperat de pe: sciencedirect.com


Nimeni nu a comentat acest articol încă.