
Structura sulfatului de potasiu (K2SO4), proprietăți, utilizări, sinteză

sulfat de potasiu este o sare anorganică albă sau incoloră a cărei formulă chimică este KDouăSW4. Era deja cunoscut în secolul al XIV-lea, fiind numit în secolul al XVII-lea ca sare duplicatum, deoarece este o combinație între o sare acidă și o sare alcalină..
Sulfatul de potasiu se găsește sub formă minerală în arcanit, dar prezentarea acestuia este mai frecventă în așa-numitele săruri Stassfurt. Acestea sunt co-cristalizări de potasiu, magneziu, calciu și sulfați de sodiu, observabile în minerale precum leonitul și polihalitul..

Sulfatul de potasiu este o sare slab toxică și provoacă iritații numai la contactul cu ochii, căile respiratorii sau tractul digestiv. Nu există dovezi ale unei acțiuni cancerigene sau mutagene.
Sulfatul de potasiu este utilizat ca îngrășământ, în special în culturile susceptibile la cloruri; acesta este cazul tutunului și cartofilor. Compusul oferă potasiu, unul dintre cei trei nutrienți principali din plante, și sulf, care este prezent în proteinele lor..
Indice articol
- 1 Structură
- 1.1 Faze cristaline
- 1.2 Încurcătură ionică
- 2 Proprietăți fizice și chimice
- 2.1 Denumiri
- 2.2 Masa molară
- 2.3 Aspect fizic
- 2.4 Densitatea
- 2.5 Punct de topire
- 2.6 Punctul de fierbere
- 2.7 Solubilitatea în apă
- 2.8 Solubilitatea în solvenți organici
- 2.9 Indicele de refracție (nD)
- 2.10 Reactivitate
- 3 Sinteza
- 3.1 Prima metodă
- 3.2 A doua metodă
- 3.3 A treia metodă
- 3.4 A patra metodă
- 4 utilizări
- 4.1 Îngrășământ
- 4.2 Utilizare industrială și ca materie primă
- 4.3 Medicament
- 4.4 Veterinar
- 4.5 Arome alimentare
- 4.6 Alte utilizări
- 5 Riscuri
- 6 Referințe
Structura
Fazele cristaline
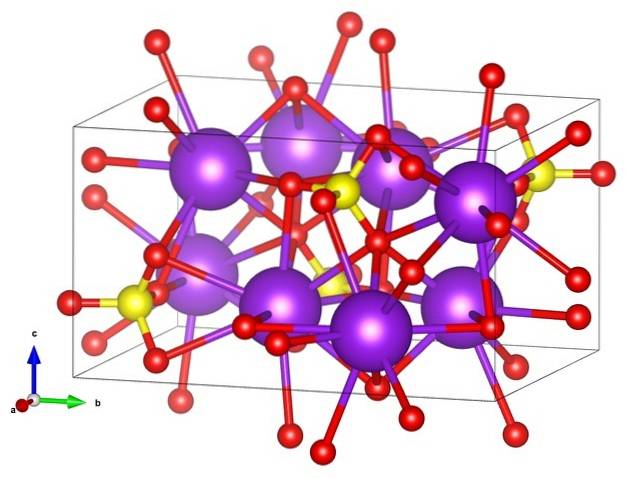
În prima imagine a fost prezentată formula structurală a sulfatului de potasiu. Pentru fiecare anion SO4Două-, de geometrie tetraedrică, există doi cationi K+, care poate fi reprezentat de sfere violete (imagine de sus).
Astfel, mai sus avem structura cristalină ortorombică a lui KDouăSW4, cu SO anioni4Două- reprezentat de sfere galbene și roșii; în timp ce cationii K+, deja spus, sunt sferele mov (un pic mai robuste).
Această reprezentare poate provoca confuzie dacă credeți că barele corespund într-adevăr legăturilor de coordonare. Mai degrabă, ele indică care ion interacționează direct sau strâns cu altul din jurul său. De aceea fiecare oxigen „se conectează” cu cinci K+ (SAU3SWDouă-- K+), iar acestea la rândul lor cu zece oxigeni din alți anioni sulfat din jur.
Există apoi o sferă de coordonare oarecum „rară” pentru potasiu în KDouăSW4:
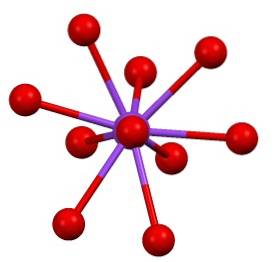
Această structură cristalină corespunde polimorfului β-KDouăSW4. Când este încălzit la 583 ºC, are loc o tranziție la faza α-KDouăSW4, care este hexagonală.
Ion încurcătură
Cu siguranță structura lui KDouăSW4 este neobișnuit de complicat pentru o sare anorganică. Ionii săi sunt poziționați formând un fel de încurcătură fără sens și, cu ochiul liber, lipsit de periodicitate.
Cei care se dedică cristalografiei pot aborda acest încurcătură într-un mod mai adecvat și descriptiv, observându-l din cele trei axe spațiale..
Rețineți că structura sa încurcată ar putea explica de ce KDouăSW4 nu formează hidrați: molecule HDouăSau nu au nicio modalitate de a pătrunde în rețeaua de cristal pentru a hidrata cationii de potasiu.
De asemenea, cu atâtea interacțiuni cuprinse în încurcătura ionică, este de așteptat ca această rețea cristalină să aibă o stabilitate destulă împotriva căldurii; și, de fapt, acesta este cazul, deoarece punctul de topire al lui KDouăSW4 este de 1.069 ºC, ceea ce arată că ionii săi sunt puternic coeziți.
Proprietati fizice si chimice

Numele
-Sulfat de potasiu
-Sulfat de potasiu
-Arcanit
-Potasiu de sulf
Masă molară
174,259 g / mol
Aspectul fizic
Cristal solid, granulat sau pulbere alb, inodor, cu gust amar.
Densitate
2,66 g / cm3
Punct de topire
1.069 ºC
Punct de fierbere
1.689 ºC
Solubilitatea apei
111 g / L la 20 ° C
120 g / L la 25 ° C
240 g / L la 100 ° C
Solubilitatea în apă scade datorită prezenței clorurii de potasiu, KCl sau sulfat de amoniu, (NH4)DouăSW4, datorită efectului ionic comun.
Solubilitate în solvenți organici
Ușor solubil în glicerol, dar insolubil în acetonă și sulfură de carbon.
Indicele de refracție (nD)
1.495
Reactivitate
Sulfatul de potasiu poate reacționa cu acidul sulfuric, acidifiant pentru a forma bisulfat de potasiu (KHSO4). Poate fi redus la temperaturi ridicate la sulfură de potasiu (KDouăS).
Sinteză
Prima metodă
Sulfatul de potasiu este sintetizat prin reacția clorurii de potasiu cu acidul sulfuric. Sinteza sulfatului de potasiu are loc în două etape. Primul pas implică formarea de bisulfat de potasiu.
Aceasta este o reacție exotermă, deoarece eliberează căldură și, prin urmare, nu necesită o sursă externă de căldură. Reacția se efectuează la temperatura camerei.
KCl + HDouăSW4 => HCI + KHSO4
Al doilea pas al reacției este endotermic, adică necesită furnizarea de căldură, astfel încât să poată apărea.
KCl + KHSO4 => HCI + KDouăSW4
A doua metodă
Sulfatul de potasiu poate fi sintetizat prin reacția de neutralizare a acidului sulfuric cu o bază, hidroxid de potasiu:
HDouăSW4 + 2 KOH => KDouăSW4 + 2 oreDouăSAU
A treia metodă
Sulfatul de potasiu este produs de reacția dioxidului de sulf, a oxigenului, a clorurii de potasiu și a apei.
A patra metodă
Sulfatul de potasiu este produs prin extragerea sulfatului de potasiu prezent într-o saramură din bazinul Loop Nur, China. Sulfatul de potasiu este separat de componentele insolubile ale saramurii prin adăugarea compusului acidifiant tripolifosfat de sodiu / fosfat de uree.
Acest compus crește diferența dintre solubilitatea sulfatului de potasiu și solubilitatea celorlalți compuși mai puțin solubili, obținând, conform creatorilor metodei, un sulfat de potasiu pur 100%. În sens strict, nu este o metodă de sinteză, ci este o metodă de extracție nouă.
Aplicații
Îngrăşământ

Utilizarea sulfatului de potasiu ca îngrășământ este principala sa aplicație. 90% din producția sa totală este utilizată în acest scop. Utilizarea sa este preferată celei de clorură de potasiu în acele culturi care sunt sensibile la prezența clorurii în sol; de exemplu tutun.
Sulfatul de potasiu are un conținut de potasiu de 40-44%, în timp ce concentrația sa de sulf reprezintă 17-18% din compus. Potasiul este necesar pentru a îndeplini multe funcții esențiale pentru plante, deoarece activează reacții enzimatice, sinteza proteinelor, formarea amidonului etc..
În plus, potasiul este implicat în reglarea fluxului de apă în frunze. Sulful este necesar pentru sinteza proteinelor, deoarece este prezent în aminoacizii care îl posedă; acesta este cazul metioninei, cisteinei și cistinei și intervine și în reacțiile enzimatice.
Chiar și sulfatul de potasiu este utilizat prin pulverizare pe frunze în particule de sulfat de potasiu mai mici de 0,015 mm.
Utilizare industrială și ca materie primă
Sulfatul de potasiu brut este utilizat la fabricarea sticlei și la fabricarea alumului și a carbonatului de potasiu. Este utilizat ca reactiv la fabricarea produselor cosmetice. Este utilizat la fabricarea berii ca agent de corecție a apei.
Medicament
Se utilizează pentru a corecta o scădere severă a concentrației plasmatice de potasiu (hipokaliemie), cauzată de utilizarea excesivă a diureticelor care cresc excreția urinară de potasiu..
Potasiul este principalul ion intracelular al celulelor excitabile, inclusiv celulele cardiace. Prin urmare, o scădere severă a potasiului în plasmă compromite funcția cardiacă și trebuie corectată imediat..
Sulfatul de potasiu are o acțiune catartică, adică favorizează expulzarea scaunului din colon. Din acest motiv, un amestec de sulfati de potasiu, magneziu si sodiu este folosit pentru a curata colonul de scaun inainte de a efectua o colonoscopie, ceea ce permite o vizualizare mai buna a colonului de catre medic..
veterinar
Sulfatul de potasiu a fost utilizat pentru a reduce necesarul de metionină în hrana păsărilor. Prezența 0,1% sulfat de potasiu în hrana găinilor ouătoare este asociată cu o creștere de 5% a producției de ouă.
Arome alimentare
Este un agent aromatizant care conferă alimentelor un gust amar și sărat, care este de dorit în unele dintre ele. În plus, se remarcă faptul că sulfatul de potasiu este dotat cu cele patru arome de bază: dulceață, amărăciune, aciditate și salinitate..
Salinitatea, aciditatea și amărăciunea cresc odată cu concentrația de sulfat de potasiu, în timp ce dulceața scade.
Alte utilizări
Sulfatul de potasiu este folosit ca pirotehnică, în combinație cu azotatul de potasiu, pentru a genera o flacără purpurie. Folosit ca reductor de bliț în sarcinile propulsorului de artilerie.
În plus, este utilizat ca agent de creștere a vâscozității în produsele cosmetice, cum ar fi cremele pentru față..
Riscuri
Sulfatul de potasiu este un compus cu un nivel scăzut de toxicitate, cu o letalitate foarte scăzută. LD50 pentru doza orală la șoareci este de 6.600 mg / kg greutate animală, ceea ce indică faptul că este necesară o doză mare pentru a provoca moartea șoarecelui. Aceeași valoare LD50 apare la șobolani.
La ochi, la contact, sulfatul de potasiu poate provoca iritații mecanice. Pe piele, sulfatul de potasiu produce puține daune manipulării industriale..
Dacă este înghițit, sulfatul de potasiu poate provoca iritații gastro-intestinale cu greață, vărsături și diaree. Și, în cele din urmă, inhalarea prafului de sulfat de potasiu provoacă iritații ale căilor respiratorii..
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Sulfat de potasiu. Recuperat de pe: en.wikipedia.org
- Centrul Național pentru Informații despre Biotehnologie. (2019). Sulfat de potasiu. Baza de date PubChem. CID = 24507. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Brian Clegg. (5 iulie 2018). Sulfat de potasiu. Societatea Regală de Chimie. Recuperat de pe: chemistryworld.com
- Marie T. Averbuch-Pouchot, A. Durif. (o mie nouă sute nouăzeci și șase). Subiecte în chimia fosfatului. World Scientific. Recuperat de la: books.google.co.ve
- Carte chimică. (2017). Sulfat de potasiu. Recuperat de pe: chemicalbook.com
- Shoujiang L. și colab. (2019). Purificarea și dizolvarea rapidă a sulfatului de potasiu în soluții apoase. DOI: 10.1039 / C8RA08284G
- DrugBank. (2019). Sulfat de potasiu. Recuperat de pe: drugbank.ca
- Compania Mozaic. (2019). Sulfat de potasiu. Nutriția culturilor. Recuperat de pe: cropnutrition.com
- Droguri. (2018). Sulfat de sodiu, sulfat de potasiu și sulfat de magneziu (oral). Recuperat de pe: drugs.com



Nimeni nu a comentat acest articol încă.