
Structura, proprietățile și utilizările sulfurii de argint (Ag2S)
sulfură de argint este un compus anorganic a cărui formulă chimică este AgDouăS. Este alcătuit dintr-un solid cenușiu-negru format din cationi Ag+ și anioni SDouă- într-un raport 2: 1. SDouă- este foarte asemănător cu Ag+, deoarece ambii sunt ioni moi și reușesc să se stabilizeze între ei.
Ornamentele din argint tind să se întunece, pierzându-și luciul caracteristic. Schimbarea culorii nu este un produs al oxidării argintului, ci al reacției sale cu hidrogen sulfurat prezent în mediu la concentrații scăzute; aceasta poate proveni din putrezirea sau degradarea plantelor, animalelor sau alimentelor bogate în sulf.

HDouăS, a cărui moleculă poartă un atom de sulf, reacționează cu argintul în conformitate cu următoarea ecuație chimică: 2Ag (s) + HDouăS (g) => AgDouăS (s) + HDouă(g)
Prin urmare, AgDouăS este responsabil pentru straturile negre formate pe argint. Cu toate acestea, în natură, această sulfură poate fi găsită și în mineralele Acantite și Argentite. Cele două minerale se disting de multe altele prin cristalele lor negre strălucitoare, precum cea din solidul din imaginea de mai sus..
AGDouăS are structuri polimorfe, proprietăți electronice și optoelectronice atractive, este un semiconductor și promite să fie un material pentru fabricarea dispozitivelor fotovoltaice, cum ar fi celulele solare..
Indice articol
- 1 Structură
- 2 Proprietăți
- 2.1 Greutatea moleculară
- 2.2 Aspect
- 2.3 Miros
- 2.4 Punct de topire
- 2.5 Solubilitate
- 2.6 Structura
- 2.7 Indicele de refracție
- 2.8 Constanta dielectrică
- 2.9 Electronică
- 2.10 Reacție de reducere
- 3 Nomenclatură
- 3.1 Sistematică
- 3.2 Stoc
- 3.3 Tradițional
- 4 utilizări
- 5 Referințe
Structura
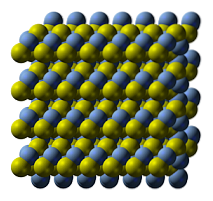
Imaginea superioară ilustrează structura cristalină a sulfurii de argint. Sferele albastre corespund cationilor Ag+, în timp ce cele galbene către anioni SDouă-. AGDouăS este polimorf, ceea ce înseamnă că poate adopta diverse sisteme de cristal în anumite condiții de temperatură..
Cum? Printr-o tranziție de fază. Ionii sunt rearanjați astfel încât creșterea temperaturii și vibrațiile solidului să nu perturbe echilibrul atracție-respingere electrostatică. Când se întâmplă acest lucru, se spune că există o tranziție de fază și, prin urmare, solidul prezintă noi proprietăți fizice (cum ar fi luciul și culoarea)..
AGDouăS la temperaturi normale (sub 179ºC), are o structură cristalină monoclinică (α- AgDouăS). În plus față de această fază solidă există și alte două: bcc (cubic centrat pe corp) între 179 până la 586ºC și fcc (cubic centrat pe fețe) la temperaturi foarte ridicate (δ- AgDouăS).
Argentitul mineral constă din faza fcc, cunoscută și sub numele de β-AgDouăS. Odată răcit și transformat în acantit, caracteristicile sale structurale predomină combinate. Prin urmare, ambele structuri cristaline coexistă: monoclinica și bcc. Prin urmare, apar solide negre cu tonuri luminoase și interesante..
Proprietăți
Greutate moleculară
247,80 g / mol
Aspect
Cristale negre cenușii
Miros
Toaletă.
Punct de topire
836 ° C. Această valoare este de acord cu faptul că AgDouăS este un compus cu caracter ionic redus și, prin urmare, se topește la temperaturi sub 1000 ° C.
Solubilitate
În apă numai 6,21 ∙ 10-cincisprezece g / L la 25 ° C. Adică, cantitatea de solid negru care este solubilizat este neglijabilă. Acest lucru, din nou, se datorează caracterului polar scăzut al legăturii Ag-S, unde nu există nicio diferență semnificativă în electronegativitate între cei doi atomi..
De asemenea, AgDouăS este insolubil în toți solvenții. Nici o moleculă nu își poate separa în mod eficient straturile cristaline în ioni Ag+ și SDouă- solvatat.
Structura
În imaginea structurii puteți vedea, de asemenea, patru straturi de legături S-Ag-S, care se deplasează unul peste celălalt atunci când solidul este supus comprimării. Acest comportament înseamnă că, în ciuda faptului că este un semiconductor, este ductil ca multe metale la temperatura camerei..
Straturile S-Ag-S se potrivesc corect datorită geometriilor lor unghiulare care sunt văzute ca un zigzag. Deoarece există o forță de compresie, acestea se deplasează pe o axă de deplasare, provocând astfel noi interacțiuni non-covalente între atomii de argint și de sulf..
Indicele de refracție
2.2
Constantă dielectrică
6
Electronic
AGDouăS este un semiconductor amfoteric, adică se comportă de parcă ar fi de tipul n și de tipul p. În plus, nu este fragil, deci a fost studiat pentru aplicarea sa pe dispozitive electronice..
Reacție de reducere
AGDouăS poate fi redus la argint metalic, scăldând bucățile negre cu apă fierbinte, NaOH, aluminiu și sare. Următoarea reacție are loc:
3AgDouăS (s) + 2Al (s) + 3HDouăO (l) => 6Ag (s) + 3HDouăS (ac) + AlDouăSAU3(s)
Nomenclatură
Argint, a cărui configurație electronică este [Kr] 4d105s1, poate pierde un singur electron: orbitalul său cel mai exterior 5s. Astfel, cationul Ag+ rămâne cu o configurație electronică [Kr] 4d10. Prin urmare, are o valență unică de +1, care determină cum ar trebui numiți compușii săi..
Sulful, pe de altă parte, are configurație electronică [Ne] 3sDouă3p4, și este nevoie de doi electroni pentru a-și completa octetul de valență. Când câștigă acești doi electroni (din argint), se transformă în anionul sulfurat, SDouă-, cu setarea [Ar]. Adică este izoelectronic pentru gazul nobil argon.
Deci, AgDouăS trebuie apelat conform următoarelor nomenclaturi:
Sistematic
Maimuţăsulfură de a datargint. Aici se ia în considerare numărul de atomi ai fiecărui element și sunt marcați cu prefixele numărătorilor greci.
Stoc
Sulfură de argint. Deoarece are o valență unică de +1, nu este specificată cu cifre romane între paranteze: sulfură de argint (I); ceea ce este greșit.
Tradiţional
Sulfură de argintico. Deoarece argintul „funcționează” cu o valență de +1, sufixului -ico i se adaugă numele. argentum În latină.
Aplicații
Unele dintre noile utilizări pentru AgDouăS sunt după cum urmează:
-Soluțiile coloidale ale nanoparticulelor sale (cu dimensiuni diferite), au activitate antibacteriană, nu sunt toxice și, prin urmare, pot fi utilizate în domeniile medicinei și biologiei..
-Nanoparticulele sale pot forma ceea ce este cunoscut sub numele de puncte cuantice. Acestea absorb și emit radiații cu o intensitate mai mare decât multe molecule organice fluorescente, astfel încât să le înlocuiască pe acestea din urmă ca markeri biologici.
-Structurile α-AgDouăS fac ca acesta să prezinte proprietăți electronice izbitoare pentru a fi utilizat ca celule solare. De asemenea, reprezintă un punct de plecare pentru sinteza de noi materiale și senzori termoelectrici..
Referințe
- Mark Peplow. (17 aprilie 2018). Sulfura de argint semiconductoare se întinde ca metalul. Luat de la: cen.acs.org
- Colaborare: Autori și editori ai volumelor III / 17E-17F-41C () Structura cristalină a sulfurii de argint (Ag2S). În: Madelung O., Rössler U., Schulz M. (eds) Elemente non-tetraedric legate și compuși binari I. Landolt-Börnstein - Grupa III Materie condensată (date numerice și relații funcționale în știință și tehnologie), vol 41C. Springer, Berlin, Heidelberg.
- Wikipedia. (2018). Sulfură de argint. Luat de pe: en.wikipedia.org
- Stanislav I. Sadovnikov & col. (Iulie 2016). AgDouăS nanoparticule de sulfură de argint și soluții coloidale: sinteză și proprietăți. Preluat de pe: sciencedirect.com
- Materiale Azo. (2018). Sulfură de argint (AgDouăS) Semiconductori. Luat de pe: azom.com
- A. Nwofe. (2015). Perspectivele și provocările filmelor subțiri de sulfură de argint: o recenzie. Divizia de Știința Materialelor și Energie Regenerabilă, Departamentul de Fizică Industrială, Universitatea de Stat Ebonyi, Abakaliki, Nigeria.
- UMassAmherst. (2011). Demonstrații de prelegere: curățarea argintului murdar. Luat de la: lecturedemos.chem.umass.edu
- Studiu. (2018). Ce este sulfura de argint? - Formula chimică și utilizări. Preluat de la: study.com


Nimeni nu a comentat acest articol încă.