
Istorie, proprietăți, structură, utilizări ale tungstenului
tungsten, tungstenul sau tungstenul este un metal greu de tranziție al cărui simbol chimic este W. Se află în perioada 6 cu grupa 6 a tabelului periodic, iar numărul său atomic este 74. Numele său are două semnificații etimologice: piatră tare și spumă de lup; al doilea se datorează faptului că acest metal este cunoscut și sub numele de tungsten.
Este un metal gri-argintiu și, deși este fragil, are o duritate mare, densitate și puncte de topire și fierbere ridicate. Prin urmare, a fost utilizat în toate acele aplicații care implică temperaturi ridicate, presiuni sau forțe mecanice, cum ar fi burghiele, proiectilele sau filamentele care emit radiații..

Cea mai cunoscută utilizare a acestui metal, la nivel cultural și popular, este în filamentele becurilor electrice. Cine le-a manipulat își va da seama cât de fragile sunt; cu toate acestea, acestea nu sunt realizate din tungsten pur, care este maleabil și ductil. În plus, în matricile metalice, cum ar fi aliajele, oferă o rezistență și o duritate excelente.
Se caracterizează și se distinge prin faptul că este metalul cu cel mai înalt punct de topire și, de asemenea, prin faptul că este mai dens decât plumbul în sine, depășit doar de alte metale, cum ar fi osmiu și iridiu. Este, de asemenea, cel mai greu metal cunoscut că joacă un rol biologic în organism..
Anionul tungstat, WO4Două-, care se poate polimeriza pentru a forma clustere într-un mediu acid. Pe de altă parte, tungstenul poate forma compuși intermetalici sau poate fi sinterizat cu metale sau săruri anorganice, astfel încât solidele sale să capete diferite forme sau consistențe..
Nu este foarte abundent în scoarța terestră, cu doar 1,5 grame din acest metal pe tonă. Mai mult, deoarece este un element greu, originea sa este intergalactică; în special din explozii de supernova, care trebuie să fi aruncat „jeturi” de atomi de tungsten spre planeta noastră în timpul formării sale.
Indice articol
- 1 Istorie
- 1.1 Etimologie
- 1.2 Recunoașterea și descoperirea
- 1.3 Oțeluri și becuri
- 2 Proprietăți
- 2.1 Aspect fizic
- 2.2 Număr atomic
- 2.3 Masa molară
- 2.4 Punct de topire
- 2.5 Punctul de fierbere
- 2.6 Densitate
- 2.7 Căldura de fuziune
- 2.8 Căldura de vaporizare
- 2.9 Capacitate termică molară
- 2.10 Duritatea lui Moh
- 2.11 Electronegativitate
- 2.12 Raza atomică
- 2.13 Rezistivitatea electrică
- 2.14 Izotopi
- 2.15 Chimie
- 2.16 Clusterizarea acidă
- 3 Structură și configurație electronică
- 3.1 Faze cristaline
- 3.2 Legătură metalică
- 3.3 stări de oxidare
- 4 Obținerea
- 5 utilizări
- 6 Riscuri și precauții
- 6.1 Biologice
- 6.2 Fizic
- 7 Referințe
Poveste
Etimologie
Istoria tungstenului sau a wolframului are două fețe precum numele lor: una elvețiană și cealaltă germană. În anii 1600, în regiunile ocupate în prezent de Germania și Austria, minerii lucrau la extracțiile de cupru și staniu pentru a produce bronzuri.
Până atunci minerii s-au trezit cu un spin în acest proces: exista un mineral extrem de dificil de topit; mineral constând din wolframit, (Fe, Mn, Mg) WO4, care a reținut sau „a devorat” tabla de parcă ar fi un lup.
De aici și etimologia acestui element, „lup” pentru lup în spaniolă, un lup care a mâncat staniu; și „berbec” de spumă sau cremă, ale cărui cristale seamănă cu o blană lungă și neagră. Astfel, numele „wolfram” sau „wolfram” a apărut în cinstea acestor prime observații.
În 1758, pe partea elvețiană, un mineral similar, scheelita, CaWO4, a fost numit „tung sten”, care înseamnă „piatră tare”.
Ambele nume, tungsten și tungsten, sunt utilizate pe scară largă în mod interschimbabil, în funcție exclusiv de cultură. În Spania, de exemplu, și în vestul Europei, acest metal este cel mai bine cunoscut sub numele de tungsten; în timp ce pe continentul american predomină numele de tungsten.
Recunoaștere și descoperire
Se știa atunci că între secolele al XVII-lea și al XVIII-lea au existat două minerale: wolframit și scheelit. Dar cine a văzut că există un metal diferit de celelalte din ele? Acestea puteau fi caracterizate doar ca minerale și în 1779 chimistul irlandez Peter Woulfe a analizat cu atenție tungstenul și a dedus existența tungstenului..
Pe partea elvețiană, din nou, Carl Wilhelm Scheele în 1781 a reușit să izoleze tungstenul ca WO3; și chiar mai mult, a obținut acid tungstic (sau tungstic), HDouăWO4 și alți compuși.
Cu toate acestea, acest lucru nu a fost suficient pentru a ajunge la metalul pur, deoarece a fost necesar să se reducă acest acid; adică supunându-l unui proces de așa natură încât se deconectează de oxigen și se cristalizează sub formă de metal. Carl Wilhelm Scheele nu a avut cuptoarele sau metodologia adecvată pentru această reacție de reducere chimică.
Aici au intrat în acțiune frații spanioli d'Elhuyar, Fausto și Juan José, care au redus ambele minerale (wolframit și scheelit) cu cărbune, în orașul Bergara. Amândouă li se acordă meritul și onoarea de a fi descoperitorii de wolframă metalică sau tungsten (W).
Oțeluri și becuri

Ca și alte metale, utilizările sale definesc istoria sa. Printre cele mai proeminente la sfârșitul secolului al XIX-lea s-au numărat aliajele de oțel-tungsten și filamentele de tungsten pentru a înlocui carbonul din becurile electrice. Se poate spune că primele becuri, așa cum le știm, au fost comercializate în anii 1903-1904.
Proprietăți
Aspectul fizic
Este un metal lucios, gri-argintiu. Fragil dar foarte dur (nu trebuie confundat cu duritatea). Dacă piesa are o puritate ridicată, ea devine maleabilă și dură, la fel de mult sau mai mult ca mai multe oțeluri.
Numar atomic
74.
Masă molară
183,85 g / mol.
Punct de topire
3422ºC.
Punct de fierbere
5930ºC.
Densitate
19,3 g / ml.
Căldura de fuziune
52,31 kJ / mol.
Căldura de vaporizare
774 kJ / mol.
Capacitatea de căldură molară
24,27 kJ / mol.
Duritatea lui Moh
7.5.
Electronegativitate
2.36 pe scara Pauling.
Radio atomic
139 pm
Rezistență electrică
52,8 nΩ · m la 20ºC.
Izotopi
Apare predominant în natură ca cinci izotopi: 182W, 183W, 184W, 186Baghetă 180W. Conform masei molare de 183 g / mol, care mediază masele atomice ale acestor izotopi (și ai celorlalte treizeci de radioizotopi), fiecare tungsten sau atom de tungsten are aproximativ o sută zece neutroni (74 + 110 = 184).
Chimie
Este un metal foarte rezistent la coroziune, ca strat subțire de WO3 Îl protejează împotriva atacului de oxigen, acid și alcali. Odată dizolvate și precipitate cu alți reactivi, se obțin sărurile sale, care se numesc tungstate sau wolframate; în ele de obicei tungstenul are o stare de oxidare de +6 (presupunând că există cationi W6+).
Clusterizarea acidă
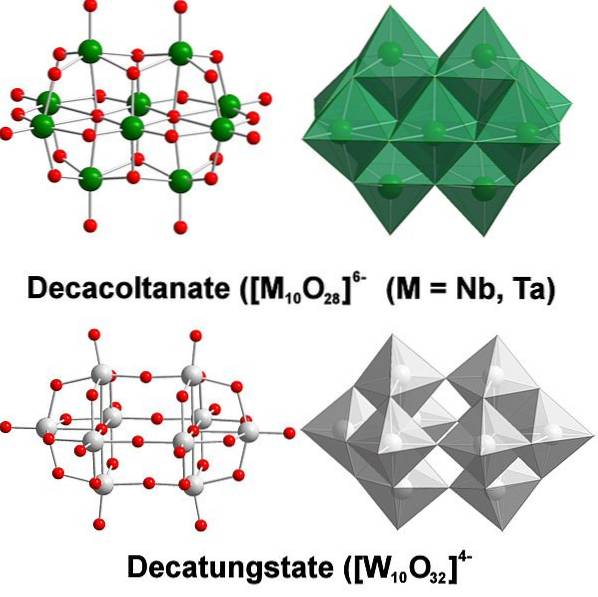
Tungstenul chimic este destul de particular deoarece ionii săi tind să se grupeze pentru a forma acizi heteropolici sau polioxometalați. Ce sunt ei? Sunt grupuri sau grupuri de atomi care se reunesc pentru a defini un corp tridimensional; În principal, unul cu o structură sferică asemănătoare cuștilor, în care „încadrează” un alt atom.
Totul începe de la anionul tungstat, WO4Două-, care în mediu acid protonează rapid (HWO4-) și se leagă cu un anion vecin pentru a forma [WDouăSAU7(OH)Două]Două-; iar acesta la rândul său se alătură cu altul [WDouăSAU7(OH)Două]Două- a proveni din [W4SAU12(OH)4]4-. Deci, până când există mai multe politungstats în soluție.
Paratungstatele A și B, [W7SAU24]6- si HDouăW12SAU4210-, respectiv, sunt unul dintre cei mai remarcabili dintre acești polianioni.
Poate fi o provocare să veniți cu schițele și structurile dvs. Lewis; dar este suficient în principiu să le vizualizăm ca seturi de octaedre WO6 (imaginea de sus).
Rețineți că aceste octaedre cenușii ajung să definească decatungstatul, un politungstat; dacă ar conține un heteroatom (de exemplu, fosfor) în interior, ar fi atunci un polioxometalat.
Structura și configurația electronică
Fazele cristaline
Atomii de tungsten definesc un cristal cu o structură cubică centrată pe corp (bcc, for cubic centrat pe corp). Această formă cristalină este cunoscută sub numele de faza a; în timp ce faza β este de asemenea cubică, dar puțin mai densă. Ambele faze sau formele cristaline, α și β, pot coexista în echilibru în condiții normale.
Boabele cristaline ale fazei α sunt izometrice, în timp ce cele din faza β seamănă cu coloanele. Indiferent de modul în care este cristalul, acesta este guvernat de legăturile metalice care mențin strâns atomii W. În caz contrar, punctele de topire și fierbere ridicate sau duritatea și densitatea ridicate a tungstenului, nu ar putea fi explicate..
Legătură metalică
Atomii de tungsten trebuie cumva să fie strâns legați. Pentru a face o presupunere, configurația electronică a acestui metal trebuie mai întâi respectată:
[Xe] 4f145 zile46sDouă
Orbitalele 5d sunt foarte mari și neclare, ceea ce ar implica faptul că între doi atomi W din apropiere există suprapuneri orbitale eficiente. La fel, orbitalele 6s contribuie la benzile rezultate, dar într-un grad mai mic. În timp ce orbitalii 4f sunt „adânci în fundal” și, prin urmare, contribuția lor la legătura metalică este mai mică.
Aceasta, dimensiunea atomilor și boabele cristaline, sunt variabilele care determină duritatea tungstenului și densitatea acestuia..
Stări de oxidare
În wolframă wolframă sau metalică atomii W au o stare de oxidare zero (W0). Revenind la configurația electronică, orbitalele 5d și 6s pot fi „golite” de electroni, în funcție de faptul dacă W este în compania atomilor puternic electronegativi, cum ar fi oxigenul sau fluorul..
Când cei doi electroni 6s se pierd, tungstenul are o stare de oxidare +2 (WDouă+), care determină contractarea atomului său.
Dacă pierde, de asemenea, toți electronii în orbitalii săi 5d, starea sa de oxidare va deveni +6 (W6+); De aici nu poate deveni mai pozitiv (teoretic), deoarece orbitalii 4f, deoarece sunt interni, ar necesita mari energii pentru a-și îndepărta electronii. Adică, cea mai pozitivă stare de oxidare este +6, unde tungstenul este și mai mic.
Acest tungsten (VI) este foarte stabil în condiții acide sau în mulți compuși oxigenați sau halogenați. Alte stări de oxidare posibile și pozitive sunt: +1, +2, +3, +4, +5 și +6.
Tungstenul poate câștiga și electroni dacă se combină cu atomi mai puțin electronegativi decât el. În acest caz, atomii săi devin mai mari. Poate câștiga maximum patru electroni; adică au o stare de oxidare de -4 (W4-).
Obținerea
S-a menționat mai devreme că tungstenul se găsește în mineralele wolframit și scheelit. În funcție de proces, din aceștia se obțin doi compuși: oxid de tungsten, WO3, sau paratungstat de amoniu, (NH4)10(HDouăW12SAU42) · 4HDouăO (sau ATP). Oricare dintre ele poate fi redusă la W metalic cu carbon peste 1050ºC.
Nu este rentabil din punct de vedere economic să producă lingouri de tungsten, deoarece acestea ar avea nevoie de multă căldură (și bani) pentru a le topi. De aceea este de preferat să se producă sub formă de pulbere pentru a o trata simultan cu alte metale pentru a obține aliaje..
Merită menționat faptul că China este țara cu cea mai mare producție de tungsten din lume. Și pe continentul american, Canada, Bolivia și Brazilia, aceștia ocupă și lista celor mai mari producători de acest metal.
Aplicații

Iată câteva dintre utilizările cunoscute pentru acest metal:
-Sărurile sale au fost folosite pentru a colora bumbacurile de îmbrăcăminte teatrală veche.
-Combinat cu oțelul îl întărește și mai mult, fiind capabil chiar să reziste tăierilor mecanice la viteze mari.
-Filamentele de tungsten sinterizate sunt folosite de peste o sută de ani în becurile electrice și lămpile cu halogen. De asemenea, datorită punctului său de topire ridicat, a servit ca material pentru tuburile cu raze catodice și pentru duzele motoarelor rachete..
-Înlocuiește plumbul la fabricarea proiectilelor și a scuturilor radioactive.
-Nanofirurile din tungsten pot fi utilizate în nanodispozitivele sensibile la pH și gaze.
-Catalizatorii de tungsten au fost folosiți pentru a face față producției de sulf în industria petrolieră.
-Carbura de tungsten este cel mai utilizat din toate compușii săi. De la întărirea uneltelor de tăiere și găurire, sau fabricarea pieselor de armament militar, la prelucrarea lemnului, a materialelor plastice și a ceramicii.
Riscuri și precauții
Biologic
Fiind un metal relativ rar în scoarța terestră, efectele sale negative sunt rare. În solurile acide, poliungstatii pot să nu afecteze enzimele care utilizează anioni molibdat; dar în solurile de bază, WO4Două- intervine (pozitiv sau negativ) în procesele metabolice ale MoO4Două- și cupru.
Plantele, de exemplu, pot absorbi compușii solubili ai tungstenului, iar atunci când un animal îi mănâncă și apoi după ce și-a consumat carnea, atomii de W pătrund în corpul nostru. Majoritatea sunt expulzați în urină și fecale și se știe puțin ce se întâmplă cu restul acestora..
Studiile efectuate pe animale au arătat că, atunci când inhală concentrații mari de pulbere de tungsten, acestea dezvoltă simptome similare cu cele ale cancerului pulmonar.
Prin ingestie, un om adult ar trebui să bea mii de litri de apă îmbogățită cu săruri de tungsten pentru a arăta o inhibare apreciabilă a enzimelor colinesterază și fosfatază..
Fizic
În termeni generali, tungstenul este un element cu conținut scăzut de toxicitate și, prin urmare, există puține riscuri pentru mediu pentru daune asupra sănătății..
În ceea ce privește tungstenul metalic, evitați să respirați praful; și dacă proba este solidă, trebuie avut în vedere că este foarte densă și că poate provoca daune fizice dacă cade sau lovește alte suprafețe.
Referințe
- Bell Terence. (s.f.). Tungsten (Wolfram): Proprietăți, producție, aplicații și aliaje. Balanta. Recuperat de pe: thebalance.com
- Wikipedia. (2019). Tungsten. Recuperat de pe: en.wikipedia.org
- Lenntech B.V. (2019). Tungsten. Recuperat de pe: lenntech.com
- Jeff Desjardins. (1 mai 2017). Istoria tungstenului, cel mai puternic metal natural de pe Pământ. Recuperat de pe: visualcapitalist.com
- Doug Stewart. (2019). Fapte despre elementul tungsten. Recuperat de pe: chemicool.com
- Art Fisher și Pam Powell. (s.f.). Tungsten. Universitatea din Nevada. Recuperat de la: unce.unr.edu
- Helmenstine, Anne Marie, dr. (02 martie 2019). Fapte despre wolfram sau Wolfram. Recuperat de pe: thoughtco.com



Nimeni nu a comentat acest articol încă.