
Volumul atomic Cum variază în tabelul periodic și exemple
volum atomic este o valoare relativă care indică relația dintre masa molară a unui element și densitatea acestuia. Deci, acest volum depinde de densitatea elementului, iar densitatea depinde la rândul său de fază și de modul în care sunt aranjați atomii în interiorul acestuia..
Deci volumul atomic pentru un element Z nu este același într-o altă fază decât cea pe care o prezintă la temperatura camerei (lichid, solid sau gazos) sau când face parte din anumiți compuși. Astfel, volumul atomic al Z din compusul ZA este diferit de cel al Z din compusul ZB.

De ce? Pentru a o înțelege, este necesar să comparați atomii cu, de exemplu, marmura. Marmurele, la fel ca cele albăstrui din imaginea de mai sus, au o margine materială foarte bine definită, care poate fi văzută datorită suprafeței lor strălucitoare. În contrast, granița atomilor este difuză, deși pot fi considerați de la distanță sferici.
Astfel, ceea ce determină un punct dincolo de granița atomică este probabilitatea nulă de a găsi un electron și acest punct poate fi mai departe sau mai aproape de nucleu, în funcție de câți atomi vecini interacționează în jurul atomului luat în considerare..
Indice articol
- 1 Volumul și raza atomică
- 2 Formula suplimentară
- 3 Cum variază volumul atomic în tabelul periodic?
- 3.1 Volumele atomice ale metalelor de tranziție
- 4 Exemple
- 4.1 Exemplul 1
- 4.2 Exemplul 2
- 5 Referințe
Volumul și raza atomică
Prin interacțiunea a doi atomi de H din molecula de HDouă, sunt definite pozițiile nucleilor lor, precum și distanțele dintre ele (distanțe internucleare). Dacă ambii atomi sunt sferici, raza este distanța dintre nucleu și limita neclară:
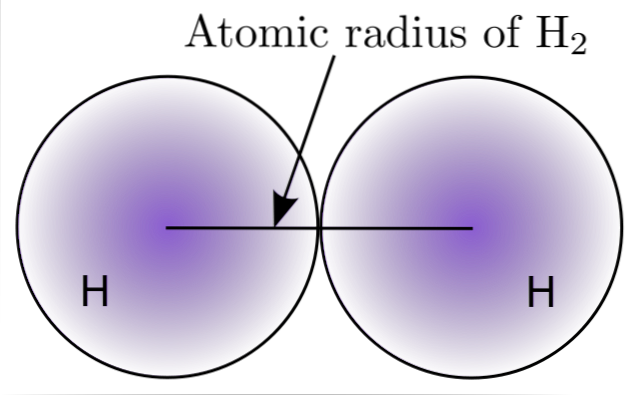
În imaginea de mai sus puteți vedea cum scade probabilitatea de a găsi un electron pe măsură ce se îndepărtează de nucleu. Împărțind distanța internucleară la două, se obține raza atomică. Apoi, presupunând o geometrie sferică pentru atomi, formula este utilizată pentru a calcula volumul unei sfere:
V = (4/3) (Pi) r3
În această expresie r este raza atomică determinată pentru molecula HDouă. Valoarea lui V calculată prin această metodă imprecisă se poate modifica dacă, de exemplu, H este luat în considerareDouă în stare lichidă sau metalică. Cu toate acestea, această metodă este foarte inexactă, deoarece formele atomilor sunt foarte departe de sfera ideală în interacțiunile lor..
Pentru a determina volumele atomice din solide, sunt luate în considerare multe variabile privind dispunerea și care sunt obținute prin studii de difracție cu raze X..
Formula suplimentară
Masa molară exprimă cantitatea de materie care are un mol de atomi ai unui element chimic.
Unitățile sale sunt g / mol. Pe de altă parte, densitatea este volumul pe care îl ocupă un gram al elementului: g / mL. Deoarece unitățile de volum atomic sunt mL / mol, trebuie să vă jucați cu variabilele pentru a ajunge la unitățile dorite:
(g / mol) (mL / g) = mL / mol
Sau ce este același:
(Masa molară) (1 / D) = V
(Masa molară / D) = V
Astfel, volumul unui mol de atomi al unui element poate fi calculat cu ușurință; pe când cu formula volumului sferic se calculează volumul unui atom individual. Pentru a ajunge la această valoare din prima, este necesară o conversie prin numărul lui Avogadro (6.02 · 10-2. 3).
Cum variază volumul atomic pe tabelul periodic?
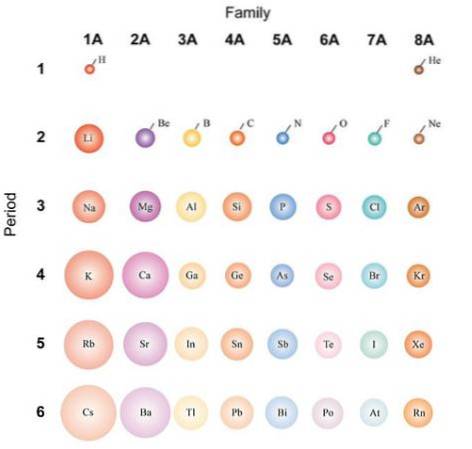
Dacă atomii sunt considerați sferici, atunci variația lor va fi aceeași cu cea observată în razele atomice. În imaginea de mai sus, care prezintă elemente reprezentative, se ilustrează că de la dreapta la stânga atomii devin mai mici; în schimb, de sus în jos devin mai voluminoase.
Acest lucru se datorează faptului că în aceeași perioadă nucleul încorporează protoni pe măsură ce se deplasează spre dreapta. Acești protoni exercită o forță atractivă asupra electronilor externi, care simt o sarcină nucleară eficientă Zef, mai mică decât sarcina nucleară reală Z.
Electronii cochiliilor interioare îi resping pe cei din cochilia exterioară, reducând efectul nucleului asupra lor; acest lucru este cunoscut sub numele de efect de ecran. În aceeași perioadă, efectul ecranului nu poate contracara creșterea numărului de protoni, astfel încât electronii din carcasa interioară nu împiedică contractarea atomilor..
Cu toate acestea, coborârea într-un grup permite noi niveluri de energie, care permit electronilor să orbiteze mai departe de nucleu. La fel, crește numărul de electroni din învelișul interior, ale cărui efecte de protecție încep să fie diminuate dacă nucleul adaugă din nou protoni..
Din aceste motive, se apreciază că grupul 1A are cei mai voluminoși atomi, spre deosebire de atomii mici din grupul 8A (sau 18), cel al gazelor nobile..
Volumele atomice ale metalelor de tranziție
Atomii metalici de tranziție încorporează electroni în orbitalele interioare. Această creștere a efectului ecranului și, precum și a sarcinii nucleare reale Z, se anulează aproape în mod egal, astfel încât atomii lor să păstreze dimensiuni similare în aceeași perioadă..
Cu alte cuvinte: într-o perioadă, metalele de tranziție prezintă volume atomice similare. Cu toate acestea, aceste mici diferențe sunt extrem de semnificative atunci când se definesc cristale metalice (ca și cum ar fi bile metalice).
Exemple
Sunt disponibile două formule matematice pentru a calcula volumul atomic al unui element, fiecare cu exemplele sale corespunzătoare.
Exemplul 1
Având în vedere raza atomică a hidrogenului -37 pm (1 picometru = 10-12m) - și cesiu -265 pm-, calculați-le volumele atomice.
Folosind formula volumului sferic, avem:
VH= (4/3) (3.14) (37 pm)3= 212.07 pm3
VCs= (4/3) (3.14) (265 pm)3= 77912297,67 pm3
Cu toate acestea, aceste volume exprimate în picometre sunt exorbitante, deci sunt transformate în unități de angstromi, înmulțindu-le cu factorul de conversie (1Å / 100pm)3:
(212.07 pm3) (1Å / 100pm)3= 2.1207 × 10-4 LA3
(77912297,67 pm3) (1Å / 100pm)3= 77.912 Å3
Astfel, diferențele de mărime dintre atomul mic H și atomul voluminos Cs sunt evidențiate numeric. Trebuie avut în vedere faptul că aceste calcule sunt doar aproximări conform afirmației că un atom este total sferic, care rătăcesc în fața realității.
Exemplul 2

Densitatea aurului pur este de 19,32 g / ml, iar masa sa molară este de 196,97 g / mol. Aplicând formula M / D pentru a calcula volumul unui mol de atomi de aur, se obține următoarele:
VAu= (196,97 g / mol) / (19,32 g / mL) = 10,19 mL / mol
Adică, 1 mol de atomi de aur ocupă 10,19 mL, dar ce volum ocupă în mod specific un atom de aur? Și cum să-l exprimăm în unități de pm3? Pentru aceasta, pur și simplu aplicați următorii factori de conversie:
(10,19 mL / mol) · (mol / 6,02 · 10-2. 3 atomi) · (1 m / 100 cm)3(13:00 / 10-12m)3= 16,92 · 106 p.m3
Pe de altă parte, raza atomică a aurului este de 166 pm. Dacă se compară ambele volume - cel obținut prin metoda anterioară și cel calculat cu formula volumului sferic - se va constata că nu au aceeași valoare:
VAu= (4/3) (3.14) (166 pm)3= 19,15 · 106 p.m3
Care dintre cele două este cel mai apropiat de valoarea acceptată? Cel mai apropiat de rezultatele experimentale obținute prin difracția cu raze X a structurii cristaline a aurului.
Referințe
- Helmenstine, Anne Marie, dr. (09 decembrie 2017). Definiția volumului atomic. Adus pe 6 iunie 2018 de la: thoughtco.com
- Mayfair, Andrew. (13 martie 2018). Cum se calculează volumul unui atom. Știința. Adus pe 6 iunie 2018, de pe: sciencing.com
- Wiki Kids Ltd. (2018). Lothar Meyer Curbele volumului atomic. Adus pe 6 iunie 2018, de pe: wonderwhizkids.com
- Lumen. Tendințe periodice: raza atomică. Adus pe 6 iunie 2018, de pe: courses.lumenlearning.com
- Camilo J. Derpich. Volumul și densitatea atomică. Adus pe 6 iunie 2018, de pe: es-puraquimica.weebly.com
- Whitten, Davis, Peck și Stanley. Chimie. (Ed. A VIII-a). CENGAGE Learning, p. 222-224.
- Fundația CK-12. (22 februarie 2010). Mărimi atomice comparative. [Figura]. Adus pe 6 iunie 2018, de pe: commons.wikimedia.org
- Fundația CK-12. Ediție (22 februarie 2010). Raza atomică a lui HDouă. [Figura]. Adus pe 6 iunie 2018, de pe: commons.wikimedia.org



Nimeni nu a comentat acest articol încă.