
Conceptul și formula volumului molar, calculul și exemplele
volumul molar Este o proprietate intensivă care indică cât spațiu ocupă un mol dintr-o anumită substanță sau compus. Este reprezentat de simbolul Vm, y se exprimă în unități de dm3/ mol pentru gaze și cm3/ mol pentru lichide și solide, deoarece acestea din urmă sunt mai limitate de forțele lor intermoleculare mai mari.
Această proprietate este recurentă atunci când se studiază sistemele termodinamice care implică gaze; deoarece, pentru lichide și solide ecuațiile pentru a determina Vm devin mai complicate și inexacte. Prin urmare, în ceea ce privește cursurile de bază, volumul molar este întotdeauna asociat cu teoria gazelor ideale..
Acest lucru se datorează faptului că aspectele structurale sunt irelevante pentru gazele ideale sau perfecte; toate particulele sale sunt vizualizate ca sfere care se ciocnesc elastic și se comportă în același mod, indiferent de masele sau proprietățile lor.
În acest caz, un mol de orice gaz ideal va ocupa, la o presiune și temperatură date, același volum Vm. Se spune apoi că, în condiții normale de P și T, 1 atm și, respectiv, 0 ° C, un mol de gaz ideal va ocupa un volum de 22,4 litri. Această valoare este utilă și aproximativă chiar și atunci când se evaluează gaze reale.
Indice articol
- 1 Concept și formulă
- 1.1 Pentru gaze
- 1.2 Pentru lichide și solide
- 2 Cum se calculează volumul molar?
- 3 Exemple de calcul al volumului molar
- 3.1 Exemplul 1
- 3.2 Exercițiul 2
- 3.3 Exercițiul 3
- 4 Referințe
Concept și formulă
Pentru gaze
Formula imediată pentru a calcula volumul molar al unei specii este:
Vm = V / n
Unde V este volumul pe care îl ocupă și n cantitatea speciei în alunițe. Problema este că Vm depinde de presiunea și temperatura pe care le experimentează moleculele și se dorește o expresie matematică care să țină seama de aceste variabile.
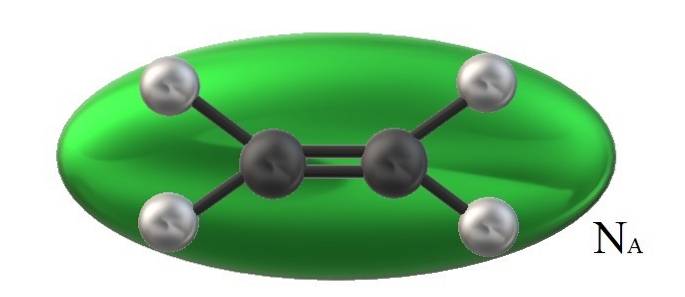
Etilena din imagine, HDouăC = CHDouă, are un volum molecular asociat limitat de un elipsoid verde. Acest HDouăC = CHDouă Se poate roti în mai multe moduri, ceea ce este ca și cum respectivul elipsoid ar fi mutat în spațiu pentru a vizualiza cât volum ar ocupa (evident neglijabil).
Totuși, dacă volumul unui astfel de elipsoid verde îl înmulțim cu NLA, Numărul lui Avogadro, vom avea apoi un mol de molecule de etilenă; un mol de elipsoizi care interacționează între ei. La temperaturi mai ridicate, moleculele se vor separa unele de altele; în timp ce la presiune mai mare, se vor contracta și își vor reduce volumul.
Prin urmare, Vm este dependentă de P și T. Etilena are o geometrie plană, deci nu se poate crede că este Vm este exact și exact același cu cel al metanului, CH4, de geometrie tetraedrică și capabil să fie reprezentat cu o sferă și nu cu un elipsoid.
Pentru lichide și solide
Moleculele sau atomii lichidelor și solidelor au, de asemenea, propriul lor Vm, care poate fi legat aproximativ de densitatea sa:
Vm = m / (dn)
Temperatura afectează volumul molar pentru lichide și solide mai mult decât presiunea, atâta timp cât acesta din urmă nu variază brusc sau este exorbitant (în ordinea GPa). La fel, după cum sa menționat cu etilena, geometriile și structurile moleculare au o mare influență asupra valorilor lui Vm.
Cu toate acestea, în condiții normale, se observă că densitățile pentru diferite lichide sau solide nu variază prea mult în ceea ce privește mărimile lor; același lucru este valabil și pentru volumele sale molare. Rețineți că cu cât sunt mai dense, cu atât va fi mai mic Vm.
În ceea ce privește solidele, volumul lor molar depinde și de structurile lor cristaline (volumul celulei lor unitare)..
Cum se calculează volumul molar?
Spre deosebire de lichide și solide, pentru gazele ideale există o ecuație care ne permite să calculăm Vm în funcție de P și T și de schimbările lor; aceasta este cea a gazelor ideale:
P = nRT / V
Ceea ce este potrivit pentru a exprima V / n:
V / n = RT / P
Vm = RT / P
Dacă folosim constanta gazului R = 0,082 L atm K-1Cârtiță-1, atunci temperaturile ar trebui exprimate în kelvin (K), iar presiunile în atmosfere. Rețineți că aici putem vedea de ce Vm este o proprietate intensivă: T și P nu au nimic de-a face cu masa gazului, ci cu volumul acestuia.
Aceste calcule sunt valabile numai în condițiile în care gazele se comportă aproape de idealitate. Cu toate acestea, valorile obținute prin experimentare au o mică marjă de eroare în raport cu teoreticul.
Exemple de calcul al volumului molar
Exemplul 1
Există un gaz Y a cărui densitate este de 8,5 · 10-4 g / cm3. Dacă avem 16 grame echivalente cu 0,92 moli de Y, calculați volumul său molar.
Din formula densității putem calcula ce volum de Y ocupă aceste 16 grame:
V = 16 g / (8,5 10-4 g / cm3)
= 18,823,52 cm3 sau 18,82 L
Deci Vm Se calculează direct împărțind acest volum la numărul de aluniți dat:
Vm = 18,82 L / 0,92 mol
= 20,45 L / mol sau L mol-1 sau dm3Cârtiță-1
Exercițiul 2
În exemplul anterior de Y, nu s-a specificat în niciun moment care a fost temperatura pe care o experimentau particulele de gaz menționate. Presupunând că Y a fost lucrat la presiunea atmosferică, calculați temperatura necesară pentru a-l comprima la volumul molar determinat.
Declarația exercițiului este mai lungă decât rezoluția sa. Folosim ecuația:
Vm = RT / P
Dar rezolvăm T și știind că presiunea atmosferică este 1 atm, rezolvăm:
T = VmRELATII CU PUBLICUL
= (20,45 L / mol) (1 atm) / (0,082 L atm / K mol)
= 249,39 K
Adică, un mol de Y va ocupa 20,45 litri la o temperatură apropiată de -23,76 ºC.
Exercițiul 3
În urma rezultatelor anterioare, determinați Vm la 0 ° C, 25 ° C și la zero absolut la presiunea atmosferică.
Transformând temperaturile în kelvin, mai întâi avem 273,17 K, 298,15 K și 0 K. Rezolvăm direct înlocuind prima și a doua temperatură:
Vm = RT / P
= (0,082 L atm / K mol) (273,15 K) / 1 atm
= 22,40 L / mol (0 ºC)
= (0,082 L atm / K mol) (298,15 K) / 1 atm
= 24,45 L / mol (25ºC)
Valoarea de 22,4 litri a fost menționată la început. Rețineți cum Vm crește odată cu temperatura. Când vrem să facem același calcul cu zero absolut, ne împiedicăm de a treia lege a termodinamicii:
(0,082 L atm / K mol) (0 K) / 1 atm
= 0 L / mol (-273,15 ºC)
Gazul Y nu poate avea un volum molar inexistent; asta înseamnă că a fost transformat într-un lichid și ecuația anterioară nu mai este valabilă.
Pe de altă parte, imposibilitatea de a calcula Vm la zero absolut respectă a treia lege a termodinamicii, care spune că este imposibil să se răcească orice substanță la temperatura zero absolut.
Referințe
- Ira N. Levine. (2014). Principiile fizico-chimiei. Ediția a șasea. Mc Graw Hill.
- Glasstone. (1970). Tratat de chimie fizică. A doua editie. Aguilar.
- Wikipedia. (2019). Volumul molar. Recuperat de pe: en.wikipedia.org
- Helmenstine, Anne Marie, dr. (08 august 2019). Definiția volumului molar în chimie. Recuperat de pe: thoughtco.com
- BYJU'S. (2019). Formula volumului molar. Recuperat de pe: byjus.com
- González Monica. (28 octombrie 2010). Volumul molar. Recuperat de pe: quimica.laguia2000.com


Nimeni nu a comentat acest articol încă.