
Proprietăți, structură, utilizări ale oxidului de clor (III)
oxid de clor (III) este un compus anorganic a cărui formulă chimică este ClDouăSAU3. Corespunde cu anhidrida acidului cloros, HClODouă. Este un solid maro închis, extrem de exploziv chiar și la temperaturi sub 0 ° C și slab caracterizat. De aceea este un obiect de interes pentru studiile computaționale..
Din punct de vedere chimic este un oxid covalent, deci există legături Cl-O și o moleculă discretă de ClDouăSAU3 (imagine inferioară). O astfel de moleculă poate fi bine formată prin deshidratarea HClODouă, sau supunând-o fotolizei la temperaturi scăzute. Detaliul este că se descompune producând ClDouă, SAUDouă, sau alți oxizi de clor stabili termodinamic.
Deoarece legăturile Cl-O sunt slab polare, molecula ClDouăSAU3 are un mic moment dipolar; prin urmare, nu se dizolvă bine în apă și nu interacționează cu alți solvenți polari. Instabilitatea sa este de așa natură încât nu este cunoscută pentru utilizări comerciale sau potențiale (nici aplicabilitatea nu ar fi viabilă ca exploziv).
Principalul motiv al instabilității sale se poate datora caracteristicilor electronice ale presupusului Cl3+ (presupunând un caracter pur ionic). De fapt, stările sale de oxidare +1 și +5 sunt cele mai stabile atunci când clorul formează compuși cu oxigenul..
Indice articol
- 1 Proprietăți
- 2 Structura oxidului de clor (III)
- 2.1 Izomeri
- 3 Nomenclatură
- 4 utilizări
- 5 Referințe
Proprietăți
Deoarece caracterizarea sa este slabă și slab documentată, nu există multe de spus despre proprietățile sale, cu excepția următoarelor puncte:
-Are o masă moleculară de 118.903.
-Este de culoare maro închis solid; deși poate sublima clorul gazos, emanând vapori verzi gălbui.
-Îi lipsește atât un punct de fierbere, cât și un punct de topire, deoarece la 0 ° C acesta explodează (și la temperaturi mai reci).
-Solubilitatea sa în apă este estimată la aproximativ 3,42 g / 100 ml, ceea ce dovedește că este o moleculă covalentă cu polaritate scăzută..
-Reacționează cu apă (puținul care se dizolvă) pentru a deveni HClODouă:
ClDouăSAU3 + HDouăSAU <=> 2HClODouă
Structura oxidului de clor (III)
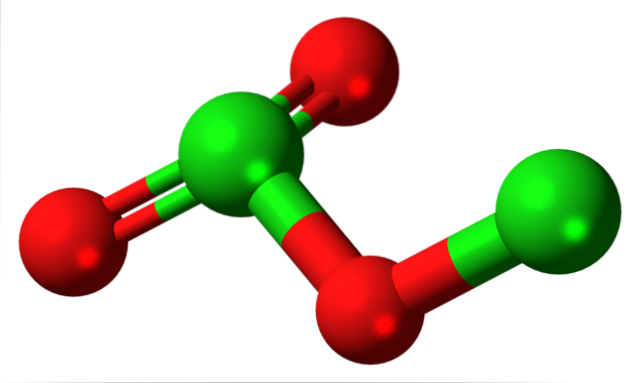
Imaginea a arătat structura moleculară a ClDouăSAU3 cu un model de sfere și bare. Deși s-ar putea să nu pară așa la prima vedere, implicațiile nerostite ale legăturilor și aranjamentelor spațiale sunt mai complicate decât apar. Această structură corespunde unuia dintre mulți izomeri posibili pentru acest compus..
Sferele roșii corespund atomilor de oxigen, iar cele verzi atomilor de clor. Clorul din stânga are o geometrie piramidală trigonală, cu o pereche de electroni liberi; deci se poate presupune că hibridizarea lor trebuie să fie sp3. Un atom de oxigen acționează ca o punte între cele două cloruri, Cl-O-Cl.
Izomeri
Care sunt ceilalți izomeri? În teorie se calculează nouă, dintre care patru sunt cele mai stabile (inclusiv cel din imagine). Celelalte trei ar avea structuri precum:
-ClClO3. Foarte similar cu cel explicat, dar cu o legătură Cl-Cl.
-CLOOOCl (1). În acest izomer există o punte de trei oxigeni care separă cei doi atomi de clor (amintiți-vă de geometria unghiulară a lui HDouăSau pentru a-l vizualiza).
-CLOOOCl (2). Același pod oxigenat este prezent și în acest izomer, cu excepția faptului că cei doi atomi de clor sunt eclipsați în spațiu; unul opus celuilalt, în timp ce în izomerul de mai sus sunt îndepărtați.
Nomenclatură
Denumirea sa, oxid de clor (III), corespunde cu cea atribuită conform nomenclaturii stocului. Aici se presupune că clorul are o stare de oxidare de +3; dar nu înseamnă că cationul Cl3+ poate fi prezent. Este o moleculă, nu o rețea de ioni.
Un alt nume sub care este cunoscut și ClDouăSAU3 este trixidul de diclor, conform nomenclaturii sistematice.
Și, în sfârșit, nu atât de obișnuit (în ciuda faptului că este guvernat de nomenclatura tradițională), există denumirea de anhidridă cloruroasă pentru a se referi la acest compus. Acest nume se datorează faptului că, după cum sa explicat deja, ClDouăSAU3 apare atunci când HClODouă condensează eliberarea de apă.
Aplicații
Deoarece este un oxid de clor, cea mai imediată utilizare care ar putea fi gândită pentru ClDouăSAU3 Este ca un agent oxidant, capabil să neutralizeze impuritățile organice și microbii. Cu toate acestea, este foarte instabil, precum și exploziv, deci nici măcar nu este considerat util în acest scop..
Cu siguranță nu există informații despre cum s-ar comporta Cl.DouăSAU3 sub o presiune enormă (dacă nu explodează în proces). În condiții normale, pare să nu fie altceva decât un intermediar relativ stabil și diferențiat între alți oxizi de clor mai stabili..
Computațional, totuși, a făcut obiectul studiului determinarea mecanismelor de radicali liberi care implică diferite specii de clor și oxigen..
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Trioxid de diclor. Recuperat de pe: en.wikipedia.org
- Dale L. Perry. (2011). Manual de compuși anorganici. (a doua editie). CRC Press Taylor & Francis Group.
- Richard C. Ropp. (2013). Enciclopedia compușilor alcalini ai pământului. Elsevier.
- Kim K. H., Han Y.K. și Lee Y. S. (1999). Efectele setului de bază asupra stabilității izomerilor Cl2O3 utilizând metodele B3P86 și B3LYP ale teoriei funcționale a densității. Journal of Molecular Structure THEOCHEM 460 (1-3): 19-25.



Nimeni nu a comentat acest articol încă.