
Structura oxidului de crom (III), nomenclatura, proprietățile, utilizările
oxid de crom (III) Oxidul cromic este un solid anorganic verde care se formează prin arderea cromului metalic (Cr) în oxigen (ODouă), lăsând cromul cu o stare de oxidare de 3+. Formula sa chimică este CrDouăSAU3. În natură se găsește în minerala Eskolaíta. Nu se cunosc depozite naturale utilizabile de oxid de crom (III).
Poate fi preparat printre alte moduri prin încălzirea CrDouăSAU3 hidratat (CrDouăSAU3.nHDouăO) pentru a îndepărta complet apa. Se obține, de asemenea, ca produs al calcinării oxidului de crom (VI) (CrO3).

Cu toate acestea, cel mai bun mod de a-l obține pur este prin descompunerea dicromatului de amoniu (NH4)DouăCrDouăSAU7 la 200 ° C. Industrial este produs prin reducerea dicromatului de sodiu (NaDouăCrDouăSAU7) solid cu sulf.
Când este fin împărțit, are o culoare verde strălucitor, cu o nuanță gălbuie. Dar dacă particulele sunt mai mari, prezintă o nuanță albăstruie. Oxidul crom este cel mai stabil pigment verde cunoscut. Rezistența sa termică și chimică îl face un colorant ceramic prețios.
Se utilizează în acoperiri industriale, lacuri, în industria construcțiilor, în bijuterii, ca colorant în produse cosmetice sau în produse farmaceutice, printre alte aplicații..
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Duritatea Mohs
- 3.3 Greutatea moleculară
- 3.4 Punctul de topire
- 3.5 Densitate
- 3.6 Solubilitate
- 3,7 pH
- 3.8 Indicele de refracție
- 3.9 Alte proprietăți
- 4 utilizări
- 4.1 În industria ceramicii și sticlei
- 4.2 În acoperirile industriale
- 4.3 În industria refractară
- 4.4 În construcție
- 4.5 Ca pigment în diferite aplicații
- 4.6 În bijuterii
- 4.7 În cataliza reacțiilor chimice
- 4.8 La fabricarea cromului
- 4.9 Pe materiale magnetice
- 4.10 Inovații recente
- 5 Referințe
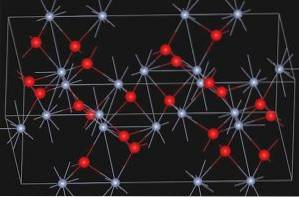
Structura
Oxid de Α-CrDouăSAU3 Are structura de tip corindon. Sistemul său de cristal este romboedru hexagonal. Este izomorf cu α-alumină și α-FeDouăSAU3.
Eskolaitul, un mineral natural de oxid de crom (III), are structura prezentată mai jos:
Nomenclatură
- Oxid de crom (III).
- Oxid de crom verde.
- Trioxid de dicrom.
- Sesquioxid de crom.
- Chromia.
- Eskolaíta: mineral de oxid de crom (III).
- Hidratează: CrDouăSAU3.nHDouăO (unde n ≅ 2) se numește Crom (III) Oxid Hidrat sau Guignet Green.

Proprietăți
Starea fizică
Solid cristalin.
Duritatea lui Mohs
9 (cristalele sale sunt extrem de dure).
Greutate moleculară
151,99 g / mol.
Punct de topire
Se topește la 2435 ° C, dar începe să se evapore la 2000 ° C, formând nori de fum verde..
Densitate
5,22 g / cm3
Solubilitate
Când a fost încălzit la temperaturi ridicate, este practic insolubil în apă (3 micrograme / L la 20 ° C); insolubil în alcooli și acetonă; ușor solubil în acizi și alcali; sSolubil în acid percloric (HClO4) la 70%, în care se descompune.
pH
6.
Indicele de refracție
2.551.
Alte proprietăți
- Dacă este calcinat puternic, devine inert față de acizi și baze. În caz contrar, CrDouăSAU3 și forma sa hidratată CrDouăSAU3.nHDouăSau sunt amfoteri, se dizolvă ușor în acid pentru a da ioni acvatici [Cr (HDouăSAU)6]3+, și în alcalin concentrat pentru a forma „cromite”.
- Când este calcinat, este rezistent chimic la acizi, alcali și la temperaturi ridicate. Este extrem de stabil la SODouă.
- Are o rezistență remarcabilă la lumină datorită faptului că cristalele sale au opacitate, atenuare ridicată a razelor UV și transparență față de lumina vizibilă..
- Este un material extrem de dur, poate zgâria cuarț, topaz și zirconiu.
- Cratul său hidratatDouăSAU3.nHDouăO (unde n ≅ 2) nu are stabilitate termică, apa de hidratare își limitează aplicabilitatea la mai puțin de 260 ° C. Vopsire redusă și gamă limitată de nuanțe.
- Dar acest hidrat are o nuanță foarte curată și strălucitoare de albastru-verde. Este semi-transparent, prezintă opacitate scăzută, rezistență excelentă la lumină și rezistență la alcali.
- CrDouăSAU3 Nu este clasificat ca material periculos și este considerat o pulbere fină inertă. Nu este supus reglementărilor internaționale de transport.
- Nu irită pielea sau membranele mucoase.
Aplicații
În industria ceramicii și sticlei
Datorită rezistenței sale ridicate la căldură și rezistență chimică, CrDouăSAU3 calcinat este utilizat ca pigment colorant sau vitrificabil la fabricarea ceramicii, a emailurilor de porțelan și a amestecurilor de sticlă.
În acoperirile industriale
Ceramica cu oxid de crom (III) oferă o rezistență excelentă împotriva celor mai corozive medii. Toate acestea prin mecanismul de excludere a substratului din mediul care îl înconjoară..
Din acest motiv, este utilizat în acoperiri pentru a preveni coroziunea multor materiale, fiind aplicat prin pulverizare termică (atomizare sau pulverizare la cald)..
De asemenea, este utilizat ca protecție împotriva uzurii abrazive (atunci când îndepărtarea materialului este cauzată de mișcarea particulelor pe o suprafață).
În aceste cazuri, aplicarea unui strat de CrDouăSAU3 prin depunerea în plasmă, generează o rezistență ridicată la abraziune.
Cele două cazuri anterioare sunt utile, de exemplu, în motoarele cu turbină cu gaz din industria aerospațială..
În industria refractară
Se utilizează la producerea cărămizilor rezistente termic și chimic, a materialelor de acoperire și a betonului refractar pe bază de alumină.
In constructie
Deoarece este extrem de rezistent la condiții atmosferice, lumină și căldură, este aplicat ca un colorant de rocă granulat pentru acoperișuri din asfalt, ciment de beton, acoperiri industriale de înaltă calitate pentru exterior, construcții din oțel și acoperiri de fațadă (vopsele emulsionabile)..
Ca pigment în diferite aplicații
Poate rezista condițiilor de vulcanizare și nu se degradează, motiv pentru care este utilizat în pigmentarea cauciucului.
Fiind netoxic este folosit ca pigment pentru jucării, produse cosmetice (în special hidratul acestuia), materiale plastice, cerneluri de imprimare, vopsele care vin în contact cu produsele alimentare și farmaceutice.
În industria pigmentară este utilizată ca materie primă pentru a produce coloranți penetranți care conțin crom și în pigmenți pe bază de faze mixte de oxid metalic. Este, de asemenea, utilizat ca un colorant de vopsea pentru acoperirea bobinelor.
Hidratul său are o transparență care permite formularea finisajelor policromate în industria auto (finisaje metalice ale automobilelor).
Datorită caracteristicii sale unice de a reflecta radiația infraroșie (IR) într-un mod similar cu clorofila din plante, sub lumina infraroșie arată ca frunziș. Din acest motiv, este utilizat pe scară largă în vopsele sau acoperiri de camuflaj pentru aplicații militare..
În bijuterii
Este folosit ca colorant pentru pietrele sintetice. Când se introduce CrDouăSAU3 ca impuritate în rețeaua cristalină a α-AlDouăSAU3, ca și în rubinul mineral semi-prețios, culoarea este roșie în loc de verde.
De asemenea, este utilizat ca agent de măcinare și lustruire pentru duritatea ridicată și proprietățile sale abrazive..
În cataliza reacțiilor chimice
Suportat în alumină (AlDouăSAU3) sau alți oxizi, este utilizat în chimia organică ca catalizator, de exemplu, în hidrogenarea esterilor sau aldehidelor pentru a forma alcooli și în ciclizarea hidrocarburilor. Catalizează reacția azotată (NDouă) cu hidrogen (HDouă) pentru a forma amoniac (NH3).
Datorită capacității sale de reducere a oxidării, acționând împreună cu oxidul de crom (VI), joacă un rol important în dehidrogenarea alcanilor cu CO.Două pentru a produce propenă și izobutenă, deoarece ciclul de dezactivare-reactivare a catalizatorului este ușor de executat. Este, de asemenea, utilizat ca catalizator în chimia anorganică.
La fabricarea cromului
Este utilizat în producția aluminotermică a cromului metalic pur. Pentru aceasta, trebuie încălzit la 1000 ° C pentru a-și crește mărimea bobului..

Pe materiale magnetice
Acesta a fost adăugat în cantități mici la materialele magnetice din casetele audio și video, conferind un efect de autocurățare a capetelor de sunet..
Inovații recente
Pigmenții care au îmbunătățit reflectanța IR aproape au fost obținuți prin doparea nanoparticulelor de CrDouăSAU3 cu săruri de elemente aparținând grupului de pământuri rare, cum ar fi lantanul și praseodimul.
Prin creșterea concentrației acestor elemente, reflectanța solară în infraroșu apropiat crește fără a afecta culoarea verde a pigmentului Cr.DouăSAU3.
Acest lucru permite CrDouăSAU3 dopat ca un pigment „rece”, deoarece este potrivit pentru controlul acumulării de căldură.
Aplicat tavanelor, automobilelor și tapițeriei, printre alte aplicații, realizează o reflectanță ridicată a razelor solare IR, ceea ce permite reducerea considerabilă a creșterii căldurii în medii.
Referințe
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.
- Kirk-Othmer (1994). Enciclopedia Tehnologiei Chimice. Volumul 19. Ediția a patra. John Wiley & Sons.
- Enciclopedia lui Ullmann de chimie industrială. (1990). Ediția a cincea. Volumul A7 și A20. VCH Verlagsgesellschaft mbH.
- Elemente americane. (2019). Oxid de crom (III). Recuperat de la americanelements.com.
- Biblioteca Națională de Medicină. (2019). Oxid de crom (III). Recuperat de la: pubchem.ncbi.nlm.nih.gov.
- Dorfman, Mitchell R. (2012). Acoperiri cu pulverizare termică. În Manualul Degradării Mediului a Materialelor. Capitolul 19. Recuperat de la sciencedirect.com.
- Takehira, K. și colab. (2004). CODouă Deshidrogenarea propanului pe catalizator Cr-MCM-41. În Studies in Surface Science and Catalysis 153. Recuperat de la sciencedirect.com.
- Selvam Sangeetha și colab. (2012). Pigmenți funcționali din nanoparticule de oxid de crom (III). Coloranți și pigmenți 94 (2012) 548-552. Recuperat de la sciencedirect.com.



Nimeni nu a comentat acest articol încă.