
Structura oxidului de etilenă, proprietăți, riscuri și utilizări
oxid de etilenă Este un compus organic din familia epoxidelor. La temperatura camerei este gazos, incolor și, deși este aproape inodor, are un miros ușor dulce, similar cu cel al eterilor..
Este un bloc chimic foarte versatil, deoarece este utilizat într-o mare varietate de aplicații industriale pentru fabricarea altor compuși chimici cu utilizări multiple. Acest lucru se datorează reactivității sale ridicate, adică ușurinței sale de a reacționa cu alte substanțe..
Una dintre aplicațiile sale principale este ca materie primă la fabricarea componentelor antigel pentru radiatoarele vehiculelor. Derivații săi sunt folosiți ca ingrediente în produsele de curățat industriale sau de uz casnic, produsele cosmetice și șampoanele, plastifianții, preparatele farmaceutice sau unguentele..
Este un dezinfectant utilizat pe scară largă, de exemplu, în sterilizarea echipamentelor medicale și dentare, deoarece este capabil să distrugă viruși, bacterii, ciuperci și spori, în special în condiții uscate. În plus, a fost folosit pentru fumigarea produselor alimentare pentru ambalare, deși această utilizare este pusă la îndoială.
În ciuda utilității sale, ar trebui să fie manipulat cu extremă prudență, deoarece poate provoca iritarea ochilor și a pielii. Inhalarea oxidului de etilenă pentru perioade lungi de timp poate afecta sistemul nervos. Prin urmare, persoanele care sunt expuse vaporilor sau soluțiilor sale ar trebui să folosească echipament de protecție și îmbrăcăminte..
Indice articol
- 1 Structură
- 2 Proprietăți
- 2.1 Alte denumiri
- 2.2 Starea fizică
- 2.3 Greutate moleculară
- 2.4 Punct de aprindere
- 2.5 Densitate
- 2.6 Solubilitate
- 2.7 Temperatura de autoinflamare
- 2.8 Alte proprietăți
- 3 Producție
- 4 Riscuri
- 4.1 Pentru sănătate
- 4.2 Incendiu
- 5 utilizări
- 5.1 Aplicații industriale
- 5.2 Aplicații medicale
- 5.3 Biblioteci și muzee
- 5.4 Agricultură și alimente
- 6 Referințe
Structura
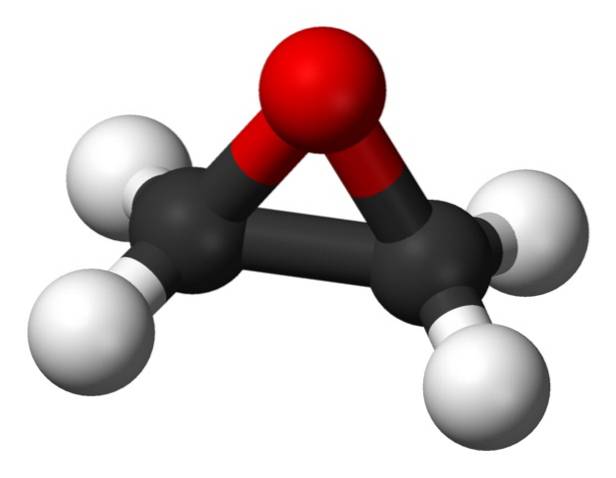
Formula sa moleculară este CDouăH4O. Aparține grupului de epoxizi, fiind cel mai simplu și cel mai important dintre aceștia. Are forma unui inel cu trei membri.
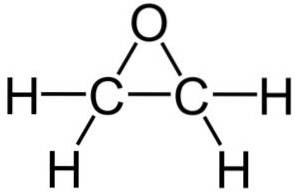
Datorită structurii sale inelare triunghiulare, oxidul de etilenă este foarte reactiv, ceea ce se datorează ușurinței cu care se deschide inelul. În medie, unghiurile de legătură sunt de 60 °, ceea ce face ca legăturile dvs. să fie slabe. Molecula este mai puțin stabilă decât cea a unui eter liniar și tinde să reacționeze cu ușurință cu alți compuși chimici..
Proprietăți
Alte nume
- Oxirano.
- Epoxietan.
Starea fizică
La temperatura camerei și sub presiunea atmosferică, este un gaz. Sub 10,6 ºC și sub presiunea atmosferică, este un lichid. Sub -111 ºC este un solid.
Greutate moleculară
44,05 g / mol.
Punct de aprindere
Mai puțin de 0 ° F (-17,8 ° C).
Densitate
Densitatea sa este mai mică decât cea a apei, fiind de 0,882 la 10 ° C. La rândul său, vaporii săi sunt mai grei decât aerul.
Solubilitate
Este solubil în apă, benzen, acetonă, etanol și eter. Este miscibil cu tetraclorura de carbon.
temperatură de autoaprindere
428,9 ºC.
Alte proprietăți
- Dacă este supus încălzirii sau contaminării, se poate polimeriza exoterm (producând cantități mari de căldură). Dacă polimerizarea are loc în interiorul unui recipient, se poate rupe violent.
- Poate reacționa cu materiale oxidante.
- Este extrem de toxic, cancerigen și este un bun generator de mutații în bacterii și celule de mamifere..
Producție
La scară industrială se prepară prin oxidarea etilenei cu oxigen (ODouă) din aer. Viteza acestei reacții crește odată cu prezența metalului argintiu (Ag) și a acțiunii temperaturii. Reacția este prezentată mai jos:
Ag, 250ºC
2 CDouăH4 + SAUDouă -> 2CDouăH4SAU
Etilen oxid de etilenă
Riscuri
Pentru sănătate
- S-a raportat că provoacă tulburări neurologice și poate provoca moartea. Cea mai mică concentrație care poate genera efecte toxice prin inhalare este de 12.500 ppm / 10 secunde (ppm înseamnă: părți pe milion).
- Este un iritant puternic pentru piele, ochi și căile respiratorii..
- Expunerea la vapori de concentrație ridicată de oxid de etilenă poate provoca iritații oculare, inflamații ale membranei oculare și leziuni ale corneei..
- Dezvoltarea cataractei a fost asociată cu expunerea la vapori și stropi. Soluțiile concentrate provoacă leziuni severe ochilor.
- Contactul cu piele a soluțiilor apoase de oxid de etilenă provoacă iritații și poate duce la dermatite severe cu vezicule și arsuri..
- Inhalarea poate afecta sistemul nervos, provocând dureri de cap și greață, printre alte simptome..
Foc
- La expunerea la flacără sau căldură există pericolul de explozie. Când sunt încălzite, sunt generate vapori periculoși.
- Vaporul formează amestecuri explozive cu aerul într-o gamă largă de concentrații.
- Evitați manipularea acestuia cu echipamente care conțin metale precum cupru, argint, mercur, magneziu, aluminiu sau oxizi de fier, precum și evitarea agenților precum amoniac, agenți oxidanți, acizi organici sau baze, printre altele. Toate aceste materiale pot accelera polimerizarea și / sau explozia lor.
Aplicații
Aplicații industriale
Este folosit ca intermediar în producția altor substanțe chimice, care la rândul lor sunt utilizate la fabricarea fibrelor de poliester pentru îmbrăcăminte, tapițerie, covoare și perne..
Oxidul de etilenă produce etilen glicolul utilizat în antigelul motorului vehiculului. Etilenglicolul este, de asemenea, utilizat la fabricarea filmelor de ambalare din fibră de sticlă și plastic..
Alte substanțe chimice produse din oxid de etilenă includ agenți tensioactivi neionici utilizați în detergenți și formule de spălat vase..
Aplicații medicale
Este utilizat ca agent de sterilizare pentru echipamente medicale, cum ar fi instrumente chirurgicale, ace și injectoare sau proteze hipodermice.
De asemenea, este utilizat pentru sterilizarea mașinilor de hemodializă, a echipamentelor de laborator, a instrumentelor dentare, a instrumentelor veterinare, a termometrelor, a îmbrăcămintei chirurgicale sau a echipamentelor de prim ajutor, printre altele..

Deși există mai multe metode disponibile pentru sterilizarea echipamentelor medicale, în unele utilizări, niciun tratament disponibil nu poate înlocui oxidul de etilenă..
Acesta este cazul sterilizării anumitor materiale sensibile la căldură și radiații, precum și a unor instrumente și dispozitive care necesită sterilizare la locul de utilizare în spitale..
Biblioteci și muzee
În aceste locuri, oxidul de etilenă este utilizat pentru combaterea dăunătorilor precum ciupercile și insectele. Cu toate acestea, această utilizare nu este atât de obișnuită și este utilizată atunci când alte alternative nu sunt eficiente..
Agricultură și alimente
A fost folosit ca pesticid, fungicid, fumigant, erbicid, insecticid, rodenticid, printre alte variante. Reduce semnificativ populația de bacterii și ciuperci din condimente.
Cu toate acestea, din motive de siguranță și de mediu, utilizarea oxidului de etilenă pentru fumigarea alimentelor a fost interzisă în Uniunea Europeană și în Statele Unite..
Referințe
- S.U.A. Biblioteca Națională de Medicină. (2019). Oxid de etilenă. Recuperat de la pubchem.ncbi.nlm.nih.gov
- Fapte de siguranță chimică. (2019). Oxid de etilenă. Recuperat de la chemicalafetyfacts.org
- Morrison, Robert Thornton; și Boyd, Robert Neilson. 1992. Chimie organică. Prentice-Hall.
- Moerman, F. și Mager, K. (2016). Curățarea și dezinfectarea în instalațiile de procesare a alimentelor uscate. În Manualul de control al igienei în industria alimentară (ediția a doua). Recuperat de la sciendirect.com.
- Eastmond, David A. și Balakrishnan, Sharada. (2010). Genotoxicitatea pesticidelor. În Hayes 'Handbook of Pesticide Toxicology (Ediția a treia). Recuperat de la sciencedirect.com
- Atungulu, G.G. și Pan, Z. (2012). Decontaminarea microbiană a nucilor și condimentelor. În decontaminarea microbiană în industria alimentară. Recuperat de la sciencedirect.com



Nimeni nu a comentat acest articol încă.