
Structura oxidului de siliciu (SiO2), proprietăți, utilizări, producție
oxid de siliciu Este un solid anorganic format prin unirea unui atom de siliciu și a doi oxigen. Formula sa chimică este SiODouă. Acest compus natural se mai numește silice sau dioxid de siliciu..
SiODouă Este cel mai abundent mineral din scoarța terestră, deoarece nisipul este compus din silice. În funcție de structura sa, silica poate fi cristalină sau amorfă. Este insolubil în apă, dar se dizolvă în alcalii și în acid fluorhidric HF.

SiODouă este prezent și în structura anumitor plante, bacterii și ciuperci. De asemenea, în scheletele organismelor marine. Pe lângă nisip, există și alte tipuri de pietre care sunt silice.
Silica este utilizată pe scară largă, îndeplinind o varietate de funcții. Cea mai răspândită utilizare este ca material filtrant pentru lichide precum uleiuri și produse petroliere, băuturi precum berea și vinul, precum și sucuri de fructe..
Dar are multe alte aplicații. Unul dintre cele mai utile și importante este în fabricarea paharelor bioactive, care permit realizarea „schelelor” în care celulele osoase cresc pentru a produce bucăți osoase lipsă din accident sau boală..
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Punctul de fierbere
- 3.5 Densitate
- 3.6 Solubilitate
- 3.7 Proprietăți chimice
- 4 Prezență în natură
- 4.1 Alte tipuri de silice naturală
- 5 Obținerea
- 6 utilizări
- 6.1 În diverse aplicații
- 6.2 În industria alimentară
- 6.3 În industria farmaceutică
- 6.4 În industria cosmeticelor și îngrijirii personale
- 6.5 În aplicații terapeutice
- 7 Riscuri
- 8 Referințe
Structura
Dioxid de siliciu SiODouă este o moleculă de trei atomi, în care atomul de siliciu este atașat la doi atomi de oxigen cu legături covalente.
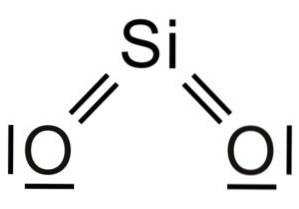
Unitatea structurală a silicei solide ca atare este un tetraedru în care un atom de siliciu este înconjurat de 4 atomi de oxigen.
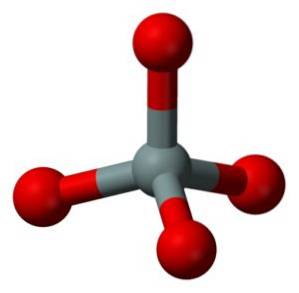
Tetraedrele sunt unite împreună prin împărțirea atomilor de oxigen ai vârfurilor lor contigue.
De aceea, un atom de siliciu împarte fiecare dintre cei 4 atomi de oxigen în jumătate și acest lucru explică relația din compusul dintre 1 atom de siliciu și 2 atomi de oxigen (SiODouă).

Compuși SiODouă sunt împărțite în două grupe: silice cristalină și silice amorfă.
Compușii de silice cristalină au structuri repetate de siliciu și oxigen.
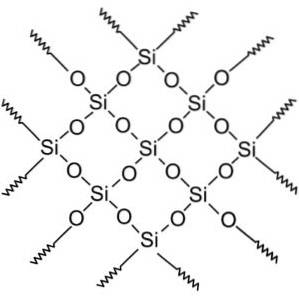
Toate cristalele de silice pot fi considerate ca o moleculă gigantică în care rețeaua cristalină este foarte puternică. Tetraedrele pot fi legate în diferite moduri, dând naștere la diferite forme cristaline.
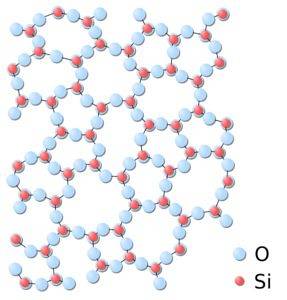
În silice amorfă, structurile sunt atașate aleatoriu, fără a urma un model regulat definit între molecule și acestea se află într-o relație spațială diferită între ele..
Nomenclatură
-Oxid de siliciu
-Dioxid de siliciu
-Silice
-Cuarţ
-Tridimit
-Cristobalita
-Dioxosilan
Proprietăți
Starea fizică
Incolor până la gri solid.

Greutate moleculară
60,084 g / mol
Punct de topire
1713 ºC
Punct de fierbere
2230 ºC
Densitate
2,17-2,32 g / cm3
Solubilitate
Insolubil în apă. Silica amorfă este solubilă în alcalii, mai ales dacă este fin divizată. Solubil în acid fluorhidric HF.
Silica amorfă este mai puțin hidrofilă, adică mai puțin legată de apă decât cea cristalină.
Proprietăți chimice
SiODouă o Silica este esențial inertă pentru majoritatea substanțelor, este foarte puțin reactivă.
Rezistă la atacul clorului ClDouă, brom BrDouă, hidrogen HDouă și din majoritatea acizilor la temperatura camerei sau puțin mai mari. Este atacat de fluor FDouă, acid fluorhidric HF și alcalii precum carbonatul de sodiu NaDouăCO3.
SiODouă Se poate combina cu elemente metalice și oxizi pentru a forma silicați. Dacă silica este fuzionată cu carbonați ai metalelor alcaline la aproximativ 1300 ° C, se obțin silicați alcalini și se eliberează CO.Două.
Nu este combustibil. Are o conductivitate termică scăzută.
Prezență în natură
Principala sursă de silice din natură este nisipul.
SiODouă sau silice este sub forma a trei soiuri cristaline: cuarț (cel mai stabil), tridimit și cristobalit. Formele amorfe de silice sunt agatul, jaspul și onixul. Opalul este o silice hidratată amorfă.
Există, de asemenea, așa-numita silice biogenă, adică cea generată de organismele vii. Sursele acestui tip de silice sunt bacteriile, ciupercile, diatomeele, bureții de mare și plantele.
Părțile strălucitoare, dure de bambus și paie conțin silice, iar scheletele unor organisme marine au, de asemenea, o proporție mare de silice; cu toate acestea, cele mai importante sunt pământurile diatomee.
Pământurile diatomee sunt produse geologice ale organismelor unicelulare în descompunere (alge).
Alte tipuri de silice naturală
În natură există și următoarele soiuri:
- Silice vitroase care sunt pahare vulcanice
- Lechaterielitele care sunt pahare naturale produse prin fuziunea materialelor silicioase sub impactul meteoriților
- Silice condensată, care este siliciu încălzit până la faza lichidă și răcit fără a-i permite cristalizarea
Obținerea
Silica din nisipuri se obține direct din cariere.

Diatomitul sau pământul de diatomee se obține și în acest fel, folosind excavatoare și echipamente similare..
Silica amorfă este preparată din soluții apoase de silicat de metal alcalin (cum ar fi Na de sodiu) prin neutralizare cu acid, cum ar fi acidul sulfuric HDouăSW4, acid clorhidric HCI sau dioxid de carbon CODouă.
Dacă pH-ul final al soluției este neutru sau alcalin, se obține silice precipitată. Dacă pH-ul este acid, se obține silicagel.
Silica fumurată este preparată prin arderea unui compus volatil de siliciu, de obicei tetraclorură de siliciu SiCl4. Silica precipitată se obține dintr-o soluție apoasă de silicați la care se adaugă acid.
Silica coloidală este o dispersie stabilă a particulelor de siliciu amorf de dimensiuni coloidale într-o soluție apoasă.
Aplicații
În diverse aplicații
Silice sau SiODouă Are o mare varietate de funcții, de exemplu, servește ca abraziv, absorbant, anti-aglomerare, umplutură, opacifiant și pentru a promova suspendarea altor substanțe, printre multe alte moduri de utilizare..
Se folosește de exemplu:
-La fabricarea sticlei, ceramicii, refractarilor, abrazivilor și sticlei de apă
-Decolorarea și purificarea uleiurilor și a produselor petroliere
-În matrițele de turnătorie
-Ca agent anti-aglomerare pentru pulberi de tot felul
-Ca spumant
-Pentru filtrarea lichidelor, cum ar fi solvenții de curățare uscată, apa de la piscină și apele uzate municipale și industriale
-La fabricarea izolației termice, a cărămizilor ignifuge și a materialelor de ambalare rezistente la foc și acid
-Ca umplutură în fabricarea hârtiei și cartonului, pentru a le face mai rezistente
-Ca umplutură de vopsea pentru a îmbunătăți fluxul și culoarea
-În materialele pentru lustruirea metalelor și lemnului, deoarece le conferă abrazivitate
-În laboratoarele de analiză chimică în cromatografie și ca absorbant
-Ca agent anti-aglomerare în formule insecticide și agrochimice, pentru a ajuta la măcinarea pesticidelor ceroase și ca purtător al compusului activ
-Ca suport catalizator
-Ca umplutură pentru a întări cauciucurile și cauciucurile sintetice
-Ca purtător de lichid în hrana animalelor
-În cernelurile tipografice
-Ca deshidratant și adsorbant, sub formă de silicagel
-Ca aditiv în ciment
-Ca gunoiul de animale
-În izolatoare pentru microelectronică
-La comutatoarele termo-optice

În industria alimentară
Silica amorfă este încorporată într-o varietate de produse alimentare ca ingredient direct multifuncțional în diferite tipuri de alimente. Nu trebuie să depășească 2% din alimentele finite.
De exemplu, servește ca agent anti-aglomerare (pentru a preveni lipirea anumitor alimente), ca stabilizator în producția de bere, ca anti-precipitant, pentru a filtra vinul, berea și sucurile de fructe sau legume.

Acționează ca un absorbant pentru lichide în unele alimente și ca o componentă a microcapsulelor pentru aromatizarea uleiurilor.
În plus, SiODouă Amorful se aplică printr-un proces special pe suprafața materialelor plastice ale ambalajelor alimentare, acționând ca o barieră.
În industria farmaceutică
Se adaugă ca agent anti-aglomerare, îngroșare, gelifiant și ca excipient, adică ca ajutor pentru comprimarea diferitelor medicamente și vitamine.
În industria cosmeticelor și îngrijirii personale
Se utilizează într-o multitudine de produse: în pudre de față, farduri de pleoape, creion de ochi, rujuri, fard de obraz, demachiante, pudre, pulberi pentru picioare, vopsele de păr și înălbitori.
De asemenea, în uleiuri și săruri de baie, băi de spumă, creme pentru mâini și corp, creme hidratante, deodorante, creme de față sau măști (cu excepția cremelor de ras), parfumuri, loțiuni și creme de curățare.
De asemenea, în cremele de hidratare de noapte, lacurile de unghii și sclipici, loțiunile răcoritoare ale pielii, tonifiantele pentru păr, pasta de dinți, balsamurile pentru păr, gelurile și cremele de bronzat.
În aplicații terapeutice
SiODouă Este prezent în sticle bioactive sau biograse a căror caracteristică principală este că pot reacționa chimic cu mediul biologic care le înconjoară, formând o legătură puternică și durabilă cu țesutul viu.
Acest tip de material este utilizat pentru a face înlocuitori osoși, cum ar fi cei din față, ca „schele” pe care vor crește celulele osoase. Au demonstrat o bună biocompatibilitate atât cu oasele, cât și cu țesuturile moi.
Aceste bioglasuri vor permite recuperarea oaselor feței pentru persoanele care le-au pierdut din accident sau boală.
Riscuri
Particulele de silice foarte fine pot deveni aeriene și pot forma prafuri neexplozive. Dar acest praf poate irita pielea și ochii. Inhalarea provoacă iritarea căilor respiratorii.
În plus, inhalarea prafului de silice provoacă leziuni progresive pe termen lung plămânilor, numite silicoză..
Referințe
- S.U.A. Biblioteca Națională de Medicină. (2019). Dioxid de siliciu. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.
- Da Silva, M.R. și colab. (2017). Tehnici de extracție verde. Absorbanți pe bază de silice. În chimia analitică cuprinzătoare. Recuperat de la sciencedirect.com.
- Ylänen, H. (editor). (2018). Ochelari bioactivi: materiale, proprietăți și aplicații (ediția a doua). Elsevier. Recuperat de pe books.google.co.ve.
- Windholz, M. și colab. (editori) (1983) Indicele Merck. O Enciclopedie a produselor chimice, a medicamentelor și a produselor biologice. Ediția a X-a. Merck & CO., Inc.
- Mäkinen, J. și Suni, T. (2015). Wafers SOI cu film gros. În Manualul materialelor și tehnologiilor MEMS pe bază de silicon (ediția a doua). Recuperat de la sciencedirect.com.
- Sirleto, L. și colab. (2010). Comutatoare termo-optice. Nanocristale de siliciu. Recuperat de la sciencedirect.com.


Nimeni nu a comentat acest articol încă.