
Formula oxidului percloric (Cl2O7), proprietăți, riscuri

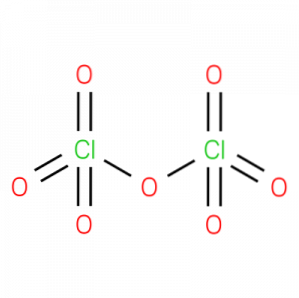
oxid percloric, numit și oxid de clor (VII), anhidridă perclorică sau dicloro heptoxid,este un compus chimic anorganic cu formula ClDouăO7. Structura sa este prezentată în figura 1.
Este unul dintre cei mai stabili oxizi de clor și reacționează cu apa pentru a produce acid percloric: ClDouăSAU7 + HDouăO D 2HClO4.
Compusul este obținut prin deshidratarea atentă a acidului percloric cu pentoxid de fosfor la -10 ° C.
2HClO4 + PDouăSAU5 ”ClDouăSAU7 + 2HPO3
Compusul este distilat pentru a-l separa de acidul metafosforic cu prudență considerabilă, având în vedere natura sa explozivă. Se poate forma și prin iluminarea în amestecuri de clor și ozon.
Proprietățile fizice și chimice ale oxidului percloric
Oxidul de clor (VII) este un lichid incolor, volatil și uleios. Greutatea sa moleculară este de 182,9 g / mol, densitatea sa este de 1900 kg / m3 și punctele sale de topire și fierbere sunt -91,57 ºC și respectiv 82 ºC..
Este exploziv spontan la impact sau în contact cu flacăra și mai ales în prezența produselor sale de descompunere..
Heptoxidul de clor se dizolvă în tetraclorură de carbon la temperatura camerei și reacționează cu apa pentru a forma acid percloric. Izbucnește la contactul cu iod.
În condiții normale, este mai stabil, deși are o putere de oxidare mai mică decât ceilalți oxizi de clor. De exemplu, nu atacă sulful, fosforul sau hârtia când este rece.
Diclor heptoxidul este un oxid puternic acid, iar în soluție formează un echilibru cu acidul percloric. Formează perclorați în prezența hidroxizilor metalelor alcaline.
Descompunerea sa termică este produsă de disocierea monomoleculară a trioxidului de clor și a radicalilor
Reactivitate și pericole
Oxidul percloric este un compus instabil. Se descompune încet la depozitare, cu producția de produse de descompunere colorate care sunt oxizi de clor mai mici.
Este exploziv spontan, mai ales în prezența produselor sale de descompunere, incompatibil cu agenții reducători, acizii puternici și bazele..
Deși este cel mai stabil oxid de clor, ClDouăSAU7 Este un oxidant puternic, precum și un exploziv care poate fi stins cu flacără sau șoc mecanic sau prin contactul cu iod..
Cu toate acestea, este mai puțin oxidant decât ceilalți oxizi de clor și nu atacă sulful, fosforul sau hârtia la rece. Are aceleași efecte asupra corpului uman ca și clorul elementar și necesită aceleași precauții
Ingerarea provoacă arsuri severe la nivelul gurii, esofagului și stomacului. Vaporii sunt foarte toxici prin inhalare.
În caz de contact cu ochii, verificați dacă purtați lentile de contact și scoateți-le imediat. Ochii trebuie spălați cu apă curentă timp de cel puțin 15 minute, ținând pleoapele deschise. Se poate folosi apa rece. Unguentul pentru ochi nu trebuie utilizat.
Dacă substanța chimică intră în contact cu îmbrăcămintea, îndepărtați-o cât mai repede posibil, protejându-vă propriile mâini și corp. Așezați victima sub un duș de siguranță.
Dacă substanța chimică se acumulează pe pielea expusă a victimei, cum ar fi mâinile, pielea contaminată este spălată ușor și cu grijă cu apă curentă și săpun non-abraziv..
Se poate folosi apa rece. Dacă iritația persistă, solicitați asistență medicală. Spălați hainele contaminate înainte de a le folosi din nou.
În caz de inhalare, victima trebuie lăsată să se odihnească într-o zonă bine ventilată. Dacă inhalarea este severă, victima trebuie evacuată într-o zonă sigură cât mai curând posibil..
Slăbiți îmbrăcămintea strânsă, cum ar fi gulerul, cămașa sau cravata cămășii. Dacă victimei îi este greu să respire, trebuie administrat oxigen.
Dacă victima nu respiră, se efectuează resuscitarea gură la gură. Ținând cont întotdeauna că poate fi periculos pentru persoana care acordă ajutor să ofere resuscitare gură la gură atunci când materialul inhalat este toxic, infecțios sau coroziv..
În toate cazurile, solicitați asistență medicală imediată.
Aplicații
Oxidul percloric nu are aplicații practice. Poate fi folosit ca agent oxidant sau pentru producerea de acid percloric, dar natura sa explozivă îl face dificil de manipulat.
Dicloro heptoxidul poate fi utilizat ca reactiv pentru producerea de perclorați sau pentru studiul cu reacții diferite.
În lucrarea lui Kurt Baum, reacțiile oxidului percloric cu olefine (Baum, 1976), alcooli (Kurt Baum, Reacții ale heptoxidului de diclor cu alcooli, 1974), ioduri de alchil și perclorat de acil cu ester (Kurt Baum, 1975) obținând halogenări și oxidări.
În cazul alcoolilor, acesta produce perclorați de alchil prin reacția cu alcooli simpli precum etilen glicol, 1,4-butadienol, 2,2,2-trifluoroetanol, 2,2-dinitropropanol. Reacționează cu 2-propanol pentru a da perclorat de izopropil. 2-hexanolul și 3-hexanolul dau perclorați neadresați și cetonele lor respective.
Propenul reacționează cu dicloro heptosid în tetraclorură de carbon pentru a da percoporat de izopropil (32%) și 1-clor, 2-propilclorurat (17%). Compusul reacționează cu cis-butenă pentru a da 3-clorobutil perclorat (30%) și 3-ceto, 2-butil perclorat (7%).
Dicloroheptoxidul reacționează cu aminele primare și secundare în soluția de tetraclorură de carbon pentru a da N-perclorați:
2 RNH2 + Cl2O7 → 2 RNHClO3 + H2O
2 R2NH + Cl2O7 → 2 R2NClO3 + H2O
De asemenea, reacționează cu alchenele pentru a da perclorați de alchil. De exemplu, reacționează cu propena în soluția de tetraclorură de carbon pentru a produce perclorat de izopropil și perclorat de 1-clor-2-propil (Beard & Baum, 1974)..
Referințe
- Baum, K. (1976). Reacțiile heptoxidului de diclor cu olefinele. Org. Chem.41 (9) , 1663-1665.
- Beard, C. D. și Baum, K ... (1974). Reacțiile heptoxidului de diclor cu aminele. Jurnalul Societății Americane de Chimie. 96 (10), 3237-3239.
- Egon Wiberg, N. W. (2001). Chimie anorganică. Academic Press: Londra.
- EMBL-EBI. (2009, 25 aprilie). heptaoxid de diclor. Adus de la ChEBI: ebi.ac.uk.
- Kurt Baum, C. D. (1974). Reacțiile heptoxidului de clor cu alcooli. Am. Chem. Soc., 96 (10), 3233-3237.
- Kurt Baum, C. D. (1975). Reacțiile heptoxidului de diclor și ale percloraților de acil cu eteri. Org. Chem., 40 (1) , 81-85.
- Kurt Baum, C. D. (1975). Reacțiile heptoxidului de diclor și ale hipoalitilor cu ioduri de alchil. Org. Chem., 40 (17), 2536-2537.
- Societatea Regală de Chimie. (2015). Heptoxid de diclor. Adus de la chemspider: chemspider.com.



Nimeni nu a comentat acest articol încă.