
Absorbanță ce este, exemple și exerciții rezolvate
absorbanta este logaritmul cu semn negativ al coeficientului dintre intensitatea luminii emergente și intensitatea luminii incidente pe un eșantion de soluție translucidă care a fost iluminată cu lumină monocromatică. Acest coeficient este transmitanță.
Se numește procesul fizic al trecerii luminii printr-o probă transmisia luminii, iar absorbția este o măsură a acesteia. Prin urmare, absorbanța devine cel mai mic logaritm al transmitanței și este o informație importantă pentru a determina concentrația unei probe care este în general dizolvată într-un solvent precum apa, alcoolul sau oricare altul..
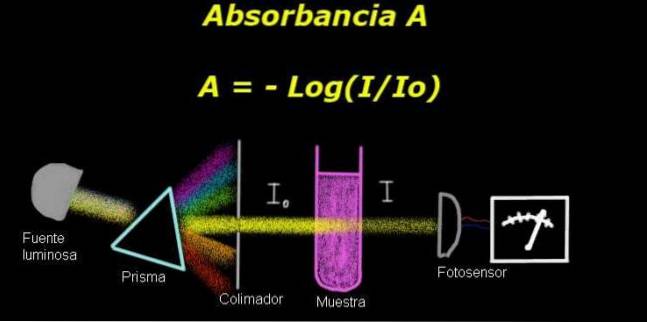
Pentru a măsura absorbanța, aveți nevoie de un dispozitiv numit electrofotometru, cu care se măsoară un curent proporțional cu intensitatea luminii incidente de pe suprafața sa.
Când se calculează transmitanța, de obicei semnalul de intensitate corespunzător solventului este măsurat mai întâi și acest rezultat este înregistrat ca Io.
Apoi proba dizolvată este plasată în solvent în aceleași condiții de iluminare. Semnalul măsurat de electrofotometrul este notat ca Eu, care permite calcularea transmitanței T conform următoarei formule:
T = I / Isau
Este o cantitate adimensională. absorbanta A este astfel exprimat ca:
A = - log (T) = - log (I / Isau)
Indice articol
- 1 Absorbanță molară și absorbție
- 1.1 Legea lui Beer-Lambert
- 2 Exemple
- 2.1 Exemplul 1
- 2.2 Exemplul 2
- 3 exerciții rezolvate
- 3.1 Exercițiul 1
- 3.2 Exercițiul 2
- 3.3 Exercițiul 3
- 4 Referințe
Absorbanță și absorbție molară
Moleculele care alcătuiesc o substanță chimică sunt capabile să absoarbă lumina, iar o măsură din aceasta este tocmai absorbția. Este rezultatul interacțiunii dintre fotoni și electroni moleculari.
Prin urmare, este o magnitudine care va depinde de densitatea sau concentrația moleculelor care alcătuiesc proba și, de asemenea, de calea optică sau distanța parcursă de lumină..
Datele experimentale indică faptul că absorbția LA este liniar proporțională cu concentrația C și la distanță d străbătut de lumină. Deci, pentru a-l calcula pe baza acestor parametri, se poate stabili următoarea formulă:
A = ε⋅C⋅d
În formula de mai sus, ε este o constantă de proporționalitate cunoscută sub numele de absorbtia molara.
Absorbția molară depinde de tipul substanței și de lungimea de undă la care se măsoară absorbanța. absorbtia molara este, de asemenea, sensibil la temperatura probei și la pH-ul probei.
Legea Beer-Lambert
Această relație între absorbanță, absorbabilitate, concentrație și distanța grosimii căii pe care o urmează lumina în cadrul eșantionului este cunoscută sub numele de legea Beer-Lambert..

Iată câteva exemple de utilizare.
Exemple
Exemplul 1
În timpul unui experiment, o probă este iluminată cu lumină roșie de la un laser cu heliu-neon, a cărui lungime de undă este de 633 nm. Un electrofotometru măsoară 30 mV atunci când lumina laserului lovește direct și 10 mV când trece printr-o probă..
În acest caz, transmitanța este:
T = I / Io = 10 mV / 30 mV = ⅓.
Și absorbția este:
A = - log (⅓) = log (3) = 0,48
Exemplul 2
Dacă aceeași substanță este plasată într-un recipient care are jumătate din grosimea celei utilizate în exemplul 1, spuneți cât va marca electrofotometrul, când lumina de la laserul cu heliu-neon este trecută prin probă.
Trebuie avut în vedere că, dacă grosimea scade la jumătate, atunci absorbanța proporțională cu grosimea optică scade la jumătate, adică A = 0,28. Transmitanța T va fi dată de următoarea relație:
T = 10-A = 10 ^ (- 0,28) = 0,53
Electrofotometrul va citi 0,53 * 30 mV = 15,74 mV.
Exerciții rezolvate
Exercitiul 1
Vrem să determinăm absorbția molară a unui anumit compus de proprietate care este în soluție. Pentru a face acest lucru, soluția este iluminată cu lumina de la o lampă de sodiu de 589 nm. Eșantionul va fi plasat într-un suport de eșantion de 1,50 cm grosime.
Punctul de plecare este o soluție cu o concentrație de 4,00 × 10 ^ -4 moli pe litru și transmitanța este măsurată, rezultând 0,06. Folosind aceste date, determinați absorbția molară a probei..
Soluţie
În primul rând, se determină absorbanța, care este definită ca cel mai mic logaritm la baza zece a transmitanței:
A = - jurnal (T)
A = - log (0,06) = 1,22
Apoi se folosește legea Lambert-Beer care stabilește o relație între absorbanță, absorbție molară, concentrație și lungime optică:
A = ε⋅C⋅d
Rezolvând absorbția molară, se obține următoarea relație:
ε = A / (C⋅d)
înlocuind valorile date avem:
ε = 1,22 / (4,00 × 10 ^ -4 M⋅1,5 cm) = 2030 (M⋅cm) ^ - 1
Rezultatul de mai sus a fost rotunjit la trei cifre semnificative.
Exercițiul 2
Pentru a îmbunătăți precizia și a determina eroarea de măsurare a absorbtivității molare a probei în exercițiul 1, proba este diluată succesiv la jumătate din concentrație și transmitanța este măsurată în fiecare caz..
Pornind de la Co = 4 × 10 ^ -4 M cu transmitanța T = 0,06, se obține următoarea secvență de date pentru transmitanță și absorbanță calculată din transmitanță:
Co / 1-> 0,06-> 1,22
Co / 2-> 0,25-> 0,60
Co / 4-> 0,50-> 0,30
Co / 8-> 0,71-> 0,15
Co / 16-> 0,83-> 0,08
Co / 32-> 0,93-> 0,03
Co / 64-> 0,95-> 0,02
Co / 128-> 0,98-> 0,01
Co / 256-> 0,99-> 0,00
Cu aceste date efectuați:
a) Un grafic al absorbanței versus concentrație.
b) O potrivire liniară a datelor și găsiți panta.
c) Din panta obținută, calculați absorbția molară.
Soluţie
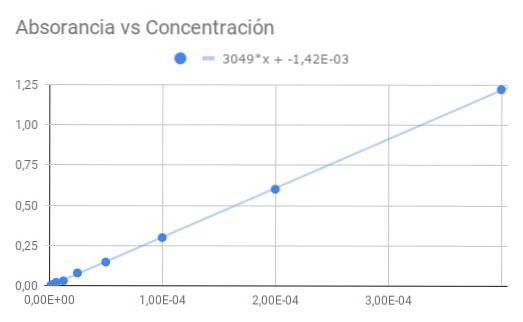
Panta obținută este produsul absorbției molare și a distanței optice, deci împărțind panta la lungimea de 1,5 cm obținem absorbția molară
ε = 3049 / 1,50 = 2033 (M⋅cm) ^ - 1
Exercițiul 3
Cu datele din exercițiul 2:
a) Calculați absorbția pentru fiecare dată.
b) Determinați o valoare medie pentru absorbția molară, abaterea standard a acesteia și eroarea statistică asociată cu media..
Soluţie
Absorbtivitatea molară este calculată pentru fiecare dintre concentrațiile testate. Amintiți-vă că condițiile de iluminare și distanța optică rămân fixe.
Rezultatele pentru absorbția molară sunt:
2033, 2007, 2007, 1983, 2158, 1681, 2376, 1.872, 1862 în unități de 1 / (M * cm).
Din aceste rezultate putem lua valoarea medie:
<ε> = 1998 (M * cm) ^ - 1
Cu o abatere standard de: 184 (M * cm) ^ - 1
Eroarea medie este abaterea standard împărțită la rădăcina pătrată a numărului de date, adică:
Δ<ε>= 184/9 ^ 0,5 = 60 (M * cm) ^ - 1
În cele din urmă, se concluzionează că substanța brevetată are o absorbție molară la frecvența de 589 nm produsă de o lampă de sodiu de:
<ε> = (2000 ± 60) (M * cm) ^ - 1
Referințe
- Atkins, P. 1999. Chimie fizică. Ediții Omega. 460-462.
- Ghidul. Transmitență și absorbanță. Recuperat de pe: quimica.laguia2000.com
- Toxicologie de mediu. Transmitență, absorbanță și legea lui Lambert. Recuperat de la: repositorio.innovacionumh.es
- Aventura fizică. Absorbanta si transmitanta. Recuperat de pe: rpfisica.blogspot.com
- Spectofotometrie. Recuperat de pe: chem.libretexts.org
- Toxicologie de mediu. Transmitență, absorbanță și legea lui Lambert. Recuperat de la: repositorio.innovacionumh.es
- Wikipedia. Absorbanta Recuperat de pe: wikipedia.com
- Wikipedia. Spectrofotometrie. Recuperat de pe: wikipedia.com



Nimeni nu a comentat acest articol încă.