
Caracteristicile, tipurile, funcțiile adenilat ciclazei
adenilat ciclază sau adenil ciclaza este enzima responsabilă de conversia ATP, o moleculă cu energie ridicată, în AMP ciclic, o importantă moleculă de semnalizare care activează diferite proteine AMP dependente de ciclic cu funcții fiziologice importante.
Activitatea sa este controlată de diverși factori, cum ar fi, de exemplu, acțiunea concertată a hormonilor, neurotransmițătorilor și a altor molecule reglatoare de natură diferită (ioni de calciu divalenți și proteine G, pentru a numi doar câțiva)..
Principala importanță a acestei enzime constă în importanța produsului reacției pe care o catalizează, AMP ciclic, deoarece participă la controlul multor fenomene celulare legate de metabolism și dezvoltare, precum și de răspunsul la diferiți stimuli externi..
În natură, atât organismele unicelulare (relativ simple), cât și animalele multicelulare mari și complexe folosesc AMP ciclic ca al doilea mesager și, prin urmare, enzimele care îl produc..
Studiile filogenetice stabilesc că aceste enzime derivă dintr-un strămoș comun înainte de separarea eubacteriilor și eucariotelor, sugerând că AMP ciclic avea funcții diferite, probabil legate de producția de ATP..
Este posibil să acceptăm o astfel de afirmație, deoarece reacția catalizată de adenilat ciclază este ușor reversibilă, ceea ce poate fi observat la constanta de echilibru pentru sinteza ATP (Kechiv ≈ 2,1 ± 0,2 10-9 MDouă).
Indice articol
- 1 Caracteristici și structură
- 1.1 Caracteristici structurale
- 1.2 Sit catalitic
- 1.3 Locație
- 2 tipuri
- 2.1 Ciclazele adenilat de mamifere
- 3 Funcții
- 4 Regulament
- 5 Referințe
Caracteristici și structură
Majoritatea enzimelor eucariote adenilat ciclază sunt asociate cu membrana plasmatică, dar în bacterii și celule de spermă de mamifere se găsesc ca proteine solubile în citosol.
În drojdie și în unele bacterii sunt proteine de membrană periferică, în timp ce în anumite specii de amibă sunt molecule cu un singur segment transmembranar.
Caracteristici structurale
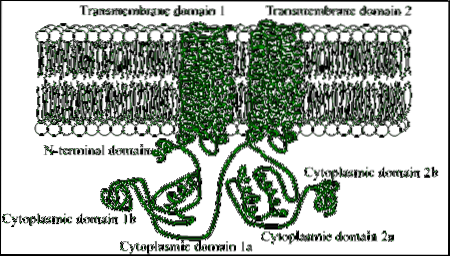
Sunt proteine compuse din lanțuri polipeptidice mari (cu mai mult de 1.000 de reziduuri de aminoacizi), care traversează membrana plasmatică de 12 ori prin două regiuni compuse din șase domenii transmembranare de conformație a helixului alfa..
Fiecare regiune transmembranară este separată de un domeniu citosolic mare, care este responsabil pentru activitatea catalitică..
Printre organismele eucariote există câteva motive conservate într-un fragment din regiunea amino terminală a acestor enzime, precum și un domeniu citoplasmatic de aproximativ 40 kDa, care este delimitat de secțiunile hidrofobe.
Sit catalitic
Reacția pe care aceste enzime o catalizează, adică formarea unei legături diesterice printr-un atac nucleofil al grupării OH în poziția 3 'la gruparea fosfat a nucleozidului trifosfat în poziția 5', depinde de un motiv structural comun cunoscut sub numele de domeniul Palm ".
Acest domeniu de „palmă” este compus dintr-un motiv „βαβααβ"(" Β "adică foile pliate β și" α "helicele alfa) și are două reziduuri invariante de acid aspartic care coordonează cei doi ioni metalici responsabili de cataliză, care pot fi ioni de magneziu sau magneziu divalenți..
Multe studii legate de structura cuaternară a acestor enzime au relevat că unitatea lor catalitică există ca un dimer a cărui formare depinde de segmentele transmembranare, care se unesc în reticulul endoplasmatic în timpul formării proteinei..
Locație
S-a stabilit că, la fel ca multe proteine integrale de membrană, cum ar fi proteinele G, cele cu ancore fosfatidilinozitolice și multe altele, adenil ciclasele se găsesc în regiuni speciale de membrană sau micro-domenii cunoscute sub numele de „plute lipidice” (din engleză „Pluta lipidică”).
Aceste domenii de membrană pot avea un diametru de până la sute de nanometri și sunt compuse în principal din colesterol și sfingolipide cu lanțuri lungi și predominant saturate de acizi grași, ceea ce le face mai puțin fluide și permite acomodarea segmentelor transmembranare ale diferitelor proteine..
De asemenea, s-au găsit cicluri de adenilat asociate cu subregiuni de plute lipidice cunoscute sub numele de "caveolae" (din engleză "caveolae "), care sunt mai degrabă invaginații ale membranei bogate în colesterol și o proteină asociată cu aceasta numită caveolin.
Tipuri
În natură, există trei clase bine definite de adenilat ciclază și două care fac în prezent obiectul discuției..
- Clasa I: sunt prezente în multe bacterii gram-negative, cum ar fi E coli, de exemplu, unde produsul AMP ciclic al reacției funcționează ca un ligand pentru factorii de transcripție responsabili de reglarea operonilor catabolici.
- Clasa II: întâlnită la unii agenți patogeni din genuri bacteriene precum Bacil sau Bordetella, unde servesc ca toxine extracelulare. Sunt proteine activate de calmodulina gazdei (absentă în bacterii).
- Clasa III: Acestea sunt cunoscute sub numele de clasa „universală” și sunt legate filogenetic de guanilat ciclasele, care îndeplinesc funcții similare. Se găsesc atât în procariote, cât și în eucariote, unde sunt reglementate de căi diferite.
Adenilat ciclasele de mamifere
La mamifere, cel puțin nouă tipuri de enzime au fost clonate și descrise, codificate de nouă gene independente și aparținând adenil ciclazei de clasa III.
Acestea împărtășesc structuri complexe și topologii de membrană, precum și domenii catalitice duplicate care le sunt caracteristice..
Pentru mamifere, nomenclatura utilizată pentru a se referi la izoforme corespunde literelor AC (pentru adenilat ciclază) și un număr de la 1 la 9 (AC1 - AC9). Au fost raportate, de asemenea, două variante ale enzimei AC8.
Izoformele prezente la aceste animale sunt omoloage în ceea ce privește secvența structurii primare a siturilor lor catalitice și structura tridimensională. Includerea uneia dintre aceste enzime în cadrul fiecărui „tip” este legată în principal de mecanismele de reglare care operează pe fiecare izoformă.
Au modele de expresie care sunt adesea specifice țesuturilor. Toate izoformele pot fi găsite în creier, deși unele sunt limitate la zone specifice ale sistemului nervos central.
Caracteristici
Funcția principală a enzimelor aparținând familiei Adenilat Ciclazei este de a transforma ATP în AMP ciclic și pentru aceasta catalizează formarea unei legături diester intramoleculare 3'-5 'diester (reacție similară cu cea catalizată de ADN polimeraze). a unei molecule de pirofosfat.
La mamifere, diferitele variante care pot fi realizate au fost legate de proliferarea celulară, dependența de etanol, plasticitatea sinaptică, dependența de medicamente, ritmul circadian, stimularea olfactivă, învățarea și memoria..
Unii autori au sugerat că ciclenele adenilat pot avea o funcție suplimentară ca molecule de transport sau, ceea ce este același lucru, proteine de canal și transportori ionici..
Cu toate acestea, aceste ipoteze au fost testate numai pe baza aranjamentului sau topologiei segmentelor transmembranare ale acestor enzime, care împărtășesc unele omologii sau similarități structurale (dar nu secvențe) cu anumite canale de transport ionic..
Atât AMP ciclic, cât și PPi (pirofosfat), care sunt produsele reacției, au funcții la nivel celular; dar importanța lor depinde de organismul în care se află.
Regulament
Marea diversitate structurală dintre adenil ciclasele demonstrează o mare susceptibilitate la multiple forme de reglare, care le permite să se integreze într-o mare varietate de căi de semnalizare celulară..
Activitatea catalitică a unora dintre aceste enzime depinde de cetoacizi alfa, în timp ce altele au mecanisme de reglare mult mai complexe care implică subunități de reglare (prin stimulare sau inhibare) care depind, de exemplu, de calciu și de alți factori general solubili, precum și de alți proteine.
Multe ciclase de adenilat sunt reglementate negativ de subunitățile unor proteine G (inhibă funcția lor), în timp ce altele exercită efecte mai active.
Referințe
- Cooper, D. M. F. (2003). Reglarea și organizarea ciclicelor adenilil și AMPc. Jurnal Biochimic, 375, 517-529.
- Cooper, D., Mons, N. și Karpen, J. (1995). Ciclazele adenilil și interacțiunea dintre semnalizarea calciului și AMPc. Natură, 374, 421-424.
- Danchin, A. (1993). Filogenia ciclurilor adenilil. Progrese în cercetarea Second Messenger și fosfoproteine, 27, 109-135.
- Hanoune, J. și Defer, N. (2001). Reglarea și rolul izoformelor adenilil ciclazei. Ann. Pr. Pharmacol. Toxicol., 41, 145-174.
- Linder, U., și Schultz, J. E. (2003). Ciclazele de adenilil de clasa III: module de semnalizare multifuncționale. Semnalizare celulară, cincisprezece, 1081-1089.
- Tang, W. și Gilman, A. G. (1992). Cicluri adenilil. Celula, 70, 669-672.



Nimeni nu a comentat acest articol încă.