
Istoricul siliciului, proprietăți, structură, obținere, utilizări
siliciu Este un element nemetalic și în același timp metaloid care este reprezentat de simbolul chimic Si. Este un semiconductor, care este o parte esențială a computerelor, calculatoarelor, telefoanelor mobile, celulelor solare, diodelor etc; Este practic componenta principală care a permis înființarea erei digitale.
Siliciul a fost întotdeauna prezent în cuarț și silicați, ambele minerale reprezentând aproximativ 28% din masa întregii scoarțe terestre. Este, astfel, al doilea cel mai abundent element de pe suprafața Pământului, iar vastitatea deșerturilor și a plajelor oferă o perspectivă a cât de abundentă este..

Siliciul aparține grupului 14 din tabelul periodic, la fel ca și carbonul, situat sub acesta. De aceea acest element este considerat un metaloid tetravalent; Are patru electroni de valență și teoretic îi poate pierde pe toți pentru a forma cationul Si4+.
O proprietate pe care o împarte cu cărbunele este capacitatea sa de a se lega între ele; adică atomii lor sunt legați covalent pentru a defini lanțuri moleculare. La fel, siliciul își poate forma propriile „hidrocarburi”, numite silani..
Compușii predominanți ai siliciului în natură sunt celebrii silicați. În forma sa pură poate apărea ca un solid monocristalin, policristalin sau amorf. Este un solid relativ inert, deci nu reprezintă riscuri considerabile.
Indice articol
- 1 Istorie
- 1.1 Piatra de siliciu
- 1.2 Izolarea
- 1.3 Siliciul cristalin
- 2 Proprietăți fizice și chimice
- 2.1 Aspect fizic
- 2.2 Masa molară
- 2.3 Număr atomic (Z)
- 2.4 Punct de topire
- 2.5 Punctul de fierbere
- 2.6 Densitate
- 2.7 Căldura de fuziune
- 2.8 Căldura de vaporizare
- 2.9 Capacitate termică molară
- 2.10 Electronegativitate
- 2.11 Energiile de ionizare
- 2.12 Raza atomică
- 2.13 Conductivitatea termică
- 2.14 Rezistivitate electrică
- 2.15 Duritatea lui Mohs
- 2.16 Concatenare
- 2.17 numere de oxidare
- 2.18 Reactivitate
- 3 Structură și configurație electronică
- 3.1 Caracter covalent
- 3.2 Conductivitatea electrică
- 3.3 Siliciul amorf
- 4 Unde se găsește și se obține
- 4.1 -Reducerea silicei
- 5 izotopi
- 6 Riscuri
- 7 utilizări
- 7.1 Industria construcțiilor
- 7.2 Sticlă și ceramică
- 7.3 Aliaje
- 7.4 Desicanti
- 7.5 Industria electronică
- 7.6 Polimeri de silicon
- 8 Referințe
Poveste
Piatra de siliciu
Siliciul este probabil unul dintre elementele care au avut cea mai mare influență în istoria omenirii.
Acest element este protagonistul epocii de piatră, precum și al epocii digitale. Originile sale datează de când civilizațiile au lucrat odată cu cuarț și și-au făcut propriile ochelari; și în prezent, este componenta principală a computerelor, laptopurilor și smartphone-urilor.
Siliciul a fost practic piatra a două ere clar definite în istoria noastră.
Izolare
Deoarece silica este atât de abundentă, un nume născut din roca de silex, trebuie să conțină un element extrem de bogat în scoarța terestră; aceasta a fost suspiciunea corectă a lui Antoine Lavoisier, care în 1787 a eșuat în încercările sale de a-l reduce din rugina sa.
Ceva mai târziu, în 1808, Humphry Davy și-a făcut propriile încercări și i-a dat elementului prenumele: „silicium”, care s-ar traduce ca „metal de silex”. Adică, siliciul era considerat atunci un metal din cauza lipsei de caracterizare..
Apoi, în 1811, chimiștii francezi Joseph L. Gay-Lussac și Louis Jacques Thénard au reușit să pregătească siliciu amorf pentru prima dată. Pentru aceasta au reacționat tetrafluorura de siliciu cu potasiu metalic. Cu toate acestea, nu au purificat sau caracterizat produsul obținut, așa că nu au ajuns la concluzia că acesta era noul element silicium.
Abia în 1823 chimistul suedez Jacob Berzelius a obținut un siliciu amorf cu o puritate suficientă pentru a-l recunoaște ca siliciu; nume dat în 1817 de chimistul scoțian Thomas Thomson când îl considera un element nemetalic. Berzelius a efectuat reacția dintre fluorosilicat de potasiu și potasiu topit pentru a produce acest siliciu.
Siliciul cristalin
Siliciul cristalin a fost preparat pentru prima dată în 1854 de chimistul francez Henry Deville. Pentru a realiza acest lucru, Deville a efectuat o electroliză a unui amestec de cloruri de aluminiu și sodiu, obținând astfel cristale de siliciu acoperite de un strat de silicură de aluminiu, pe care le-a eliminat (aparent) prin spălarea lor cu apă..
Proprietati fizice si chimice
Aspectul fizic

Siliciul în forma sa pură sau elementară este format dintr-un solid cenușiu sau negru-albăstrui (imaginea superioară), care, deși nu este un metal, are fețe strălucitoare ca și cum ar fi într-adevăr.
Este un solid dur, dar fragil, care prezintă și o suprafață solzoasă dacă este alcătuit din policristale. Siliciul amorf, pe de altă parte, arată ca un solid praf de culoare maro închis. Datorită acestui fapt, este ușor să identificați și să diferențiați un tip de siliciu (cristalin sau policristalin) de altul (amorf).
Masă molară
28,085 g / mol
Număr atomic (Z)
14 (14Da)
Punct de topire
1414 ºC
Punct de fierbere
3265 ºC
Densitate
-La temperatura camerei: 2,33 g / ml
-Chiar la punctul de topire: 2,57 g / ml
Rețineți că siliciu lichid este mai dens decât siliciu solid; ceea ce înseamnă că cristalele sale vor pluti pe o fază lichidă a acesteia, așa cum se întâmplă cu sistemul gheață-apă. Explicația se datorează faptului că spațiul interatomic dintre atomii de Si din cristalul lor este mai mare (mai puțin dens) decât cel corespunzător din lichid (mai dens).
Căldura de fuziune
50,21 kJ / mol
Căldura de vaporizare
383 kJ / mol
Capacitatea de căldură molară
19,789 J / (mol K)
Electronegativitate
1,90 pe scara Pauling
Energiile de ionizare
-Mai întâi: 786,5 kJ / mol
-Al doilea: 1577,1 kJ / mol
-În al treilea rând: 3231,6 kJ / mol
Radio atomic
111 pm (măsurat pe cristalele lor de diamant respective)
Conductivitate termică
149 W / (m K)
Rezistență electrică
2.3 103 Ω · m la 20 ºC
Duritatea lui Mohs
6.5
Concatenare
Atomii de siliciu au capacitatea de a forma legături simple Si-Si, care ajung să definească un lanț (Si-Si-Si ...).
Această proprietate se manifestă și prin carbon și sulf; cu toate acestea, hibridizări sp3 siliciu sunt mai deficitare în comparație cu celelalte două elemente și, în plus, orbitalele lor 3p sunt mai difuze, astfel încât suprapunerea orbitalilor sp3 rezultatul este mai slab.
Energiile medii ale legăturilor covalente Si-Si și C-C sunt de 226 kJ / mol, respectiv 356 kJ / mol. Prin urmare, legăturile Si-Si sunt mai slabe. Din acest motiv, siliciul nu este piatra de temelie a vieții (și nici sulful). De fapt, cel mai lung lanț sau schelet pe care îl poate forma siliciu este de obicei cu patru membri (Si4).
Numere de oxidare
Siliciul poate avea oricare dintre următoarele numere de oxidare, presupunând în fiecare dintre ele existența ionilor cu sarcinile lor respective: -4 (Si4-), -3 (Da3-), -2 (DaDouă-), -1 (Da-), +1 (Da+), +2 (DaDouă+), +3 (Da3+) și +4 (Da4+). Dintre toate, -4 și +4 sunt cele mai importante.
De exemplu, -4 este presupus în silicide (MgDouăDa sau MgDouăDouă+da4-); în timp ce +4 corespunde cu cel de silice (SiODouă sau daca4+SAUDouăDouă-).
Reactivitate
Siliciul este complet insolubil în apă, precum și în acizi sau baze puternice. Cu toate acestea, se dizolvă într-un amestec concentrat de acizi nitric și fluorhidric (HNO3-HF). De asemenea, se dizolvă într-o soluție alcalină fierbinte, având loc următoarea reacție chimică:
Si (s) + 2NaOH (aq) + HDouăO (l) => NaDouăda3(aq) + 2HDouă(g)
Sarea de metasilicat de sodiu, NaDouăda3, De asemenea, se formează atunci când siliciu se dizolvă în carbonat de sodiu topit:
Si (s) + NaDouăCO3(l) => NaDouăda3(l) + C (s)
La temperatura camerei nu reacționează deloc cu oxigenul, nici măcar la 900 ° C, când începe să se formeze un strat vitros protector de SiODouă; și apoi, la 1400 ° C, siliciul reacționează cu azotul din aer pentru a forma un amestec de nitruri, SiN și Si3N4.
Siliciul reacționează și la temperaturi ridicate cu metalele pentru a forma silicide metalice:
2Mg (s) + Si (s) => MgDouăDa s)
2Cu (s) + Si (s) => CuDouăDa s)
La temperatura camerei reacționează exploziv și direct cu halogeni (nu există strat de SiODouă pentru a te proteja de asta). De exemplu, avem reacția de formare a SiF4:
Da (s) + 2FDouă(g) => SiF4(g)
Și, deși siliciu este insolubil în apă, acesta reacționează la foc roșu cu un curent de vapori:
Da (s) + HDouăO (g) => SiODouă(s) + 2HDouă(g)
Structura și configurația electronică
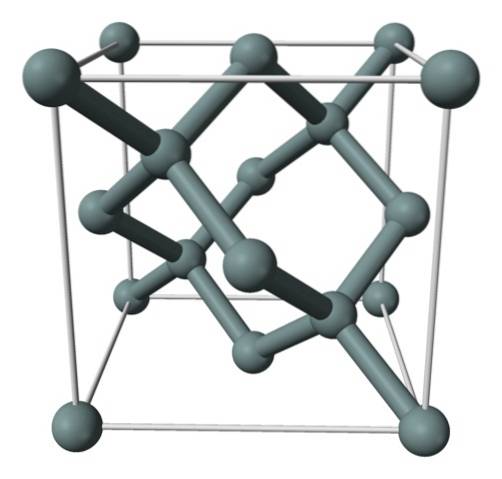
Imaginea de mai sus prezintă structura cubică centrată pe față (fcc), aceeași cu cea a diamantului, pentru cristalul de siliciu. Sferele cenușii corespund atomilor de Si, care, după cum se poate observa, sunt legați covalent între ei; în plus, au medii tetraedrice care sunt reproduse de-a lungul cristalului.
Cristalul de siliciu este fcc deoarece se observă un atom de Si situat pe fiecare dintre fețele cubului (6 × 1/2). La fel, există opt atomi de Si la vârfurile cubului (8 × 1/8) și patru situați în interiorul acestuia (cei care prezintă un tetraedru bine definit în jurul lor, 4 × 1).
Acestea fiind spuse, fiecare unitate de celule are un total de opt atomi de siliciu (3 + 1 + 4, numere indicate în paragraful de mai sus); caracteristică care ajută la explicarea durității și rigidității sale ridicate, deoarece siliciu pur este un cristal covalent ca diamantul.
Caracter covalent
Acest caracter covalent se datorează faptului că, la fel ca și carbonul, siliciul are patru electroni de valență conform configurației sale electronice:
[Ne] 3sDouă 3pDouă
Pentru legare, orbitalele 3s și 2p pure sunt inutile. De aceea atomul creează patru orbitali sp hibrizi3, cu care poate forma patru legături covalente Si-Si și, în acest fel, completează octetul de valență pentru cei doi atomi de siliciu.
Cristalul de siliciu este apoi vizualizat ca o rețea covalentă, tridimensională, compusă din tetraedre interconectate..
Cu toate acestea, această rețea nu este perfectă, deoarece are defecte și limite ale granulelor, care separă și definesc un cristal de altul; și când astfel de cristale sunt foarte mici și numeroase, vorbim despre un solid policristalin, identificat prin luciul său eterogen (similar cu un mozaic de argint sau o suprafață solzoasă).
Conductivitatea electrică
Legăturile Si-Si, cu electronii lor bine localizați, în principiu nu sunt de acord cu ceea ce se așteaptă de la un metal: o mare de electroni „umezindu-i” atomii; cel puțin acest lucru este așa la temperatura camerei.
Cu toate acestea, când temperatura crește, siliciul începe să conducă electricitatea și, prin urmare, se comportă ca un metal; adică este un element metaloid semiconductor.
Siliciul amorf
Tetraedrele din siliciu nu adoptă întotdeauna un model structural, dar pot fi aranjate într-un mod dezordonat; și chiar și cu atomi de siliciu ale căror hibridizări par să nu fie sp3 dar spDouă, ceea ce contribuie la creșterea în continuare a gradului de tulburare. Prin urmare, vorbim despre un siliciu amorf și necristalin.
În siliciul amorf există locuri libere electronice, unde unii dintre atomii săi au un orbital cu un electron nepereche. Datorită acestui fapt, solidul său poate fi hidrogenat, dând naștere la formarea de siliciu amorf hidrogenat; adică are legături Si-H, cu care tetraedrele sunt completate în poziții dezordonate și arbitrare.
Această secțiune este apoi încheiată spunând că siliciul poate fi prezentat în trei tipuri de solide (fără a menționa gradul său de puritate): cristalin, policristalin și amorf..
Fiecare dintre ele are propria metodă sau proces de producție, precum și aplicațiile și compromisurile sale atunci când decide care dintre cele trei să utilizeze, cunoscând avantajele și dezavantajele sale..
Unde se găsește și se obține

Siliciul este al șaptelea cel mai abundent element din Univers și al doilea din scoarța Pământului, îmbogățind și mantaua Pământului cu vasta sa familie de minerale. Acest element se asociază extrem de bine cu oxigenul, formând o gamă largă de oxizi; printre ele, silice, SODouă, și silicați (cu diverse compoziții chimice).
Silica poate fi văzută cu ochiul liber în deșerturi și plaje, deoarece nisipul este compus în principal din SiODouă. La rândul său, acest oxid poate apărea în câteva polimorfe, cele mai frecvente fiind: cuarț, ametist, agat, cristobalit, tripoli, coesit, stișovit și tridimit. În plus, poate fi găsit în solide amorfe, cum ar fi opalii și pământul diatomeu..
Între timp, silicații sunt și mai bogați din punct de vedere structural și chimic. Unele dintre mineralele silicatate includ: azbest (alb, maro și albăstrui), feldspat, argile, micas, olivine, aluminosilicați, zeoliți, amfiboli și piroxeni.
Practic, toate rocile sunt compuse din siliciu și oxigen, cu legăturile lor stabile de Si-O, și silice și silicați amestecați cu oxizi metalici și specii anorganice..
-Reducerea silicei
Problema obținerii siliciului este ruperea respectivei legături Si-O, pentru care sunt necesare cuptoare speciale și o bună strategie de reducere. Materia primă pentru acest proces este silice sub formă de cuarț, care este măcinat anterior până când este o pulbere fină..
Din această silice măcinată, se poate prepara siliciu amorf sau policristalin..
Siliciul amorf
La scară mică, efectuată într-un laborator și cu măsurile adecvate, silica este amestecată cu pulbere de magneziu într-un creuzet și incinerată în absența aerului. Apoi are loc următoarea reacție:
daDouă(s) + Mg (s) => 2MgO (s) + Si (s)
Magneziul și oxidul acestuia sunt îndepărtate cu o soluție diluată de acid clorhidric. Apoi, solidul rămas este tratat cu acid fluorhidric, astfel încât SiO să reacționezeDouă în exces; în caz contrar, excesul de magneziu favorizează formarea silicidei respective, MgDouăDa, compus nedorit pentru proces.
SiODouă devine gazul volatil SiF4, care este recuperat pentru alte sinteze chimice. În cele din urmă, masa de siliciu amorf este uscată sub un curent de hidrogen gazos..
O altă metodă similară pentru a obține siliciu amorf este aceea de a utiliza același SiF4 produs anterior sau SiCl4 (achiziționat anterior). Vaporii acestor halogenuri de siliciu sunt trecute peste sodiu lichid într-o atmosferă inertă, astfel încât reducerea gazului poate avea loc fără prezența oxigenului:
SiCI4(g) + 4Na (l) => Si (s) + 4NaCl (l)
Interesant este faptul că siliciul amorf este utilizat pentru a produce panouri solare cu un consum ridicat de energie.
Siliciul cristalin
Pornind din nou de la siliciu pulverizat sau cuarț, acestea sunt duse la un cuptor cu arc electric, unde reacționează cu cocs. În acest fel, agentul reducător nu mai este un metal, ci un material carbonos de puritate ridicată:
daDouă(s) + 2C (s) => Si (s) + 2CO (g)
Reacția produce și carbură de siliciu, SiC, care este neutralizată cu un exces de SiODouă (din nou cuarțul este în exces):
2SiC (s) + SiODouă(s) => 3Si (s) + 2CO (g)
O altă metodă de preparare a siliciului cristalin este utilizarea aluminiului ca agent reducător:
3DADouă(s) + 4Al (l) => 3Si (s) + 2AlDouăSAU3(s)
Și pornind de la sarea hexafluorurosilicat de potasiu, KDouă[SiF6], este, de asemenea, reacționat cu aluminiu metalic sau potasiu pentru a produce același produs:
KDouă[SiF6] (l) + 4Al (l) => 3Si (s) + 6KF (l) + 4AlF3(g)
Siliciul se dizolvă imediat în aluminiu topit, iar când sistemul este răcit, primul cristalizează și se separă de al doilea; adică se formează cristale de siliciu, care apar în culori cenușii.
Siliciul policristalin
Spre deosebire de celelalte sinteze sau producții, pentru a obține siliciu policristalin se începe cu o fază gaz silanică, SiH4. Acest gaz este supus unei pirolize peste 500 ° C, astfel încât să se producă o descompunere termică și astfel, din vaporii săi inițiali, policristalele de siliciu ajung să fie depuse pe o suprafață semiconductoare.
Următoarea ecuație chimică exemplifică reacția care are loc:
Da H4(g) => Si (s) + HDouă(g)
Evident, nu ar trebui să existe oxigen în cameră, deoarece ar reacționa cu SiH4:
Da H4(g) + 2ODouă(g) => SiODouă(s) + 2HDouăO (g)
Și spontaneitatea reacției de ardere este atât de mare încât are loc rapid la temperatura camerei, cu o expunere minimă a silanului la aer..
O altă cale sintetică pentru a produce acest tip de siliciu începe de la siliciu cristalin ca materie primă. Îl fac să reacționeze cu clorură de hidrogen la o temperatură de aproximativ 300 ° C, astfel încât se formează astfel triclorosilan:
Si (s) + 3HCI (g) => SiCI3H (g) + HDouă(g)
Și SiCl3H reacționează la 1100 ºC pentru a regenera siliciu, dar acum policristalin:
4SiCl3H (g) => Si (s) + 3SiCI4(g) + 2HDouă(g)
Doar uitați-vă la ecuații pentru a vă face o idee despre munca și parametrii riguroși de producție care trebuie luați în considerare..
Izotopi
Siliciul apare în mod natural și în principal ca izotop 28Da, cu o abundență de 92,23%.
În plus, există și alți doi izotopi care sunt stabili și, prin urmare, nu suferă dezintegrare radioactivă: 29Da, cu o abundență de 4,67%; Da 30Da, cu o abundență de 3,10%. Fiind atât de abundent 28Da, nu este surprinzător faptul că greutatea atomică a siliciului este de 28,084 u.
Siliciul poate fi găsit și în mai mulți radioizotopi, printre care 31Da (t1/2= 2,62 ore) și 32Da (t1/2= 153 ani). Alții (22da - 44Dacă au t1/2 foarte scurt sau scurt (mai puțin de sutimi de secundă).
Riscuri
Siliciul pur este o substanță relativ inertă, deci nu se acumulează de obicei în niciun organ sau țesut atâta timp cât expunerea la acesta este scăzută. Sub formă de pulbere, poate irita ochii, provocând rupturi sau roșeață, în timp ce atingerea acestuia poate provoca disconfort, mâncărime și peeling..
Atunci când expunerea este foarte mare, siliciul poate deteriora plămânii; dar fără efecte secundare, cu excepția cazului în care suma este suficientă pentru a provoca sufocare. Cu toate acestea, acest lucru nu este cazul cuarțului, care este asociat cu cancer pulmonar și boli precum bronșita și emfizemul..
La fel, siliciul pur este foarte rar în natură, iar compușii săi, atât de abundenți în scoarța terestră, nu prezintă niciun risc pentru mediu..
Acum, în ceea ce privește organosiliciul, acestea ar putea fi toxice; Dar, deoarece există mulți dintre ei, depinde de care este luat în considerare, precum și de alți factori (reactivitate, pH, mecanism de acțiune etc.).
Aplicații
Industrie de contructie
Mineralele din siliciu alcătuiesc „piatra” cu care sunt construite clădirile, casele sau monumentele. De exemplu, cimenturile, betoanele, stucurile și cărămizile refractare, constau din amestecuri solide pe bază de silicați. Din această abordare, ne putem imagina utilitatea acestui element în orașe și în arhitectură..
Sticlă și ceramică
Cristalele utilizate în dispozitivele optice pot fi fabricate din silice, fie ca izolatori, celule de probă, spectrofotometre, cristale piezoelectrice sau simple lentile..
La fel, atunci când materialul este preparat cu mai mulți aditivi, acesta se transformă într-un solid amorf, bine cunoscut sub numele de sticlă; iar munții de nisip sunt de obicei sursa de silice sau cuarț necesară producției sale. Pe de altă parte, cu silicați sunt fabricate materiale ceramice și porțelanuri.
Idei care se împletesc, siliciul este prezent și în meșteșuguri și ornamente.
Aliaje
Atomii de siliciu se pot uni și pot fi miscibili cu o matrice metalică, făcându-l un aditiv pentru multe aliaje sau metale; de exemplu, oțelul, pentru a realiza miezuri magnetice; bronzuri, pentru fabricarea cablurilor telefonice; și aluminiu, în producția aliajului de aluminiu-siliciu destinat pieselor de automobile ușoare.
Prin urmare, nu poate fi găsit doar în „piatra” clădirilor, ci și în metalele coloanelor lor..
Desicanti

Silica, sub formă de gel sau amorfă, face posibilă fabricarea solidelor care acționează ca desicanți prin prinderea moleculelor de apă care pătrund în recipient și păstrarea interiorului său uscat..
Industria electronică

Straturile de siliciu de diferite grosimi și culori fac parte din cipurile de computer, la fel cum au fost proiectate circuitele integrate și celulele solare (cristaline sau amorfe).
Fiind un semiconductor, încorporează atomi cu mai puțini (Al, B, Ga) sau mai mulți electroni (P, As, Sb) pentru a-l transforma în semiconductori de tipul p sau n, respectiv. Cu joncțiunile a doi siliconi, unul n si celalalt p, sunt fabricate diode emițătoare de lumină.
Polimeri de silicon
Celebrul lipici siliconic constă dintr-un polimer organic susținut de stabilitatea lanțurilor de legături Si-O-Si ... Dacă aceste lanțuri sunt foarte lungi, scurte sau reticulate, proprietățile polimerului siliconic se schimbă, precum și aplicațiile lor finale..
Printre utilizările sale, enumerate mai jos, pot fi menționate următoarele:
-Lipici sau adezivi, nu numai pentru îmbinarea hârtiei, ci și blocuri, cauciucuri, panouri de sticlă, roci etc..
-Lubrifianți în sistemele de frânare hidraulice
-Întărește vopselele și îmbunătățește strălucirea și intensitatea culorilor lor, permițându-le în același timp să reziste la schimbările de temperatură fără să se crape sau să mănânce.
-Acestea sunt folosite ca spray-uri hidrofuge, care păstrează unele suprafețe sau obiecte uscate
-Acestea dau produselor de igienă personală (paste de dinți, șampoane, geluri, creme de ras etc.) senzația de mătase
-Acoperirile sale protejează componentele electronice ale dispozitivelor delicate, cum ar fi microprocesoarele, de căldură și umiditate
-Cu polimerii de silicon, au fost făcute mai multe bile de cauciuc care sări de îndată ce sunt aruncate pe podea..
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Siliciu. Recuperat de pe: en.wikipedia.org
- MicroChemicals. (s.f.). Cristalografia siliciului. Recuperat de pe: microchemicals.com
- Lenntech B.V. (2019). Tabel periodic: siliciu. Recuperat de pe: lenntech.com
- Marques Miguel. (s.f.). Aparitia siliciului. Recuperat de la: nautilus.fis.uc.pt
- Mai mult Hemant. (5 noiembrie 2017). Siliciu. Recuperat de pe: hemantmore.org.in
- Pilgaard Michael. (22 august 2018). Siliciul: apariție, izolare și sinteză. Recuperat de pe: pilgaardelements.com
- Dr. Doug Stewart. (2019). Fapte despre elementele din siliciu. Chemicool. Recuperat de pe: chemicool.com
- Christiana Honsberg și Stuart Bowden. (2019). O colecție de resurse pentru educatorul fotovoltaic. PVeducație. Recuperat de pe: pveducation.org
- American Chemistry Council, Inc. (2019). Siliconii în viața de zi cu zi. Recuperat de pe: sehsc.americanchemistry.com

Nimeni nu a comentat acest articol încă.