
Fundația, prepararea și utilizările agarului Müeller Hinton
Agar Müeller Hinton Este un mediu nutritiv solid, neselectiv, care este compus din infuzie de carne, peptonă de cazeină acidă, amidon, agar și apă distilată. Acest mediu permite o creștere microbiană excelentă a celor mai multe bacterii cu creștere rapidă.
A fost inițial creat de John Howard Müeller și Jane Hinton pentru a izola bacteriile care necesită nutriție, cum ar fi Neisseria gonorrhoeae Da Neisseria meningitidis. Cu toate acestea, datorită caracteristicilor sale, sa dovedit a fi ideal pentru studiul susceptibilității la antibiotice, oferind rezultate fiabile și reproductibile..
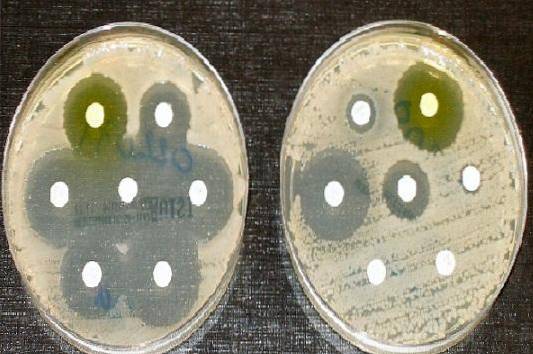
Prin urmare, agarul Müeller Hinton este mediul de cultură acceptat de Institutul de standarde clinice și de laborator (CLSI) și de Comitetul european pentru testarea sensibilității antimicrobiene, pentru efectuarea testului de susceptibilitate antimicrobiană prin metoda de difuzie a discului Kirby și Bauer.
Indice articol
- 1 Justificare
- 2 Pregătirea
- 3 utilizări
- 3.1 Tehnica antibiogramei
- 3.2 Amplasarea strategică a discurilor pe agar Müeller Hinton
- 4 Cauze ale rezultatelor eronate
- 5 Limitare
- 6 Controlul calității
- 7 Referințe
Bază
Fiind un mediu nutritiv neselectiv, este excelent pentru creșterea majorității bacteriilor patogene..
Pe de altă parte, compoziția sa simplă face ca substanțele să fie ușor difuze pe ea, fiind o caracteristică esențială pentru testul de susceptibilitate prin metoda de difuzare a discului..
O altă dintre caracteristicile sale este că conține o cantitate redusă de inhibitori, ceea ce permite evaluarea eficientă a sulfonamidelor, trimetoprimului și tetraciclinelor..
Cu toate acestea, trebuie avut în vedere faptul că suportul trebuie să îndeplinească anumite condiții pentru a asigura buna funcționare, inclusiv:
Reglarea pH-ului, adâncimea agarului și concentrația adecvată de timină, timidină, Ca++, Mg++ și Zn++.
De asemenea, trebuie să știți că metodologia este standardizată și, prin urmare, trebuie îndepliniți toți parametrii, cum ar fi:
Concentrația inoculului, concentrația și conservarea discurilor cu antibiotice, plasarea numărului adecvat de discuri pe agar, distanța dintre un disc și altul, plasarea strategică a anumitor antibiotice, atmosfera, temperatura și timpul de incubație.
Pregătirea
Se cântăresc 37 g de mediu Müeller Hinton deshidratat și se dizolvă în 1 litru de apă distilată. Încălziți mediul în timp ce amestecați pentru a ajuta la dizolvare. Se fierbe 1 minut.
Autoclavă pentru a steriliza la 121 ° C timp de 15 minute. Când se scoate din autoclavă, balonul trebuie așezat într-o baie de apă la 50 ° C pentru a se răci. Se toarnă 25-30 ml în cutii Petri sterile, cu diametrul de 10 cm.
Plăcile ar trebui să aibă o grosime medie de 4 mm (ideală), fiind permis un interval de 3-5 mm.
Dacă se dorește prepararea agarului de sânge folosind agar Müeller Hinton ca bază, se toarnă 5% sânge de miel steril și defibrinat înainte de a servi pe farfurii..
PH-ul final al mediului trebuie să fie între 7,2 și 7,4.
Investiți și păstrați-l în frigider, până la utilizare. Lăsați placa să ajungă la temperatura camerei înainte de utilizare.
Culoarea mediului pregătit este bej deschis.
Aplicații
Folosit pentru a efectua antibiograma sau testul de sensibilitate la antibiotice pentru cei mai mulți agenți patogeni cu creștere rapidă.
Dacă agarul este suplimentat cu sânge, este utilizat pentru a efectua antibiograma microorganismelor solicitante, cum ar fi: Streptococcus pneumoniae, Haemophilus sp, Neisseria meningitidis, printre alții. De asemenea, a fost folosit pentru a izola Legionella pneumophila.
Tehnica antibiogramei
Înainte de efectuarea antibiogramei, trebuie pregătită o soluție bacteriană echivalentă cu 1,5 x 10.8 celule.
Pentru aceasta, 3 până la 4 colonii de cultură pură sunt luate și suspendate într-un bulion de soia tripticază sau în bulion Müeller Hinton, incubat timp de 2 până la 6 ore și concentrația este ajustată cu ser fiziologic steril, comparându-l cu un standard Mac Farland de 0,5 %.
Dacă solicită microorganisme, coloniile pot fi suspendate direct până la concentrația de 0,5% Mac Farland. Ulterior, placa Müeller Hinton este semănată cu un tampon impregnat cu soluția bacteriană preparată..
Pentru a face acest lucru, tamponul este scufundat în soluție și apoi excesul de lichid este îndepărtat prin apăsarea pe pereții tubului. Imediat după aceea, tamponul este trecut pe toată suprafața, fără a lăsa nicio parte neatinsă, apoi placa este ușor rotită și este însămânțată din nou. Operația se repetă de încă 2 ori.
Lăsați să stea timp de 10 minute și apoi atașați discurile cu antibiotice cu o pensă sterilă, lăsând un spațiu de 24 mm între ele. După plasarea fiecărui disc pe agar, apăsați fiecare disc ușor cu forcepsul pentru a vă asigura că sunt bine aderate..
Odată ce procesul este terminat, placa este inversată și incubată la 35-37 ° C în aerobioză timp de 16 până la 18 ore. Dacă este un microorganism solicitant, poate justifica microaerofilia și dacă antibiograma conține discuri de oxacilină, trebuie citită după 24 de ore..
O riglă este utilizată pentru a măsura diametrul fiecărui halo. Rezultatele trebuie înregistrate în mm. Ulterior, valorile obținute sunt corelate cu tabelele cu puncte de tăiere publicate de manualul CLSI actual..

Raportați ca fiind sensibil (S), intermediar (I) sau rezistent (R), după caz.
Antibioticele sunt selectate în funcție de microorganismul izolat și de tipul de infecție care cauzează.
Uneori, plasarea strategică a antibioticelor trebuie luată în considerare pentru a arăta tipare fenotipice de rezistență.
Amplasarea strategică a discurilor pe agar Müeller Hinton
Pentru enterobacterii, discul cu acid clavulanic trebuie plasat împotriva cefalosporinelor de generația a III-a și a IV-a. O lărgire în formă de ou indică faptul că tulpina este un producător de beta-lactamaze cu spectru extins (ESBL). Aceasta înseamnă că pacientul nu trebuie tratat cu cefalosporine..
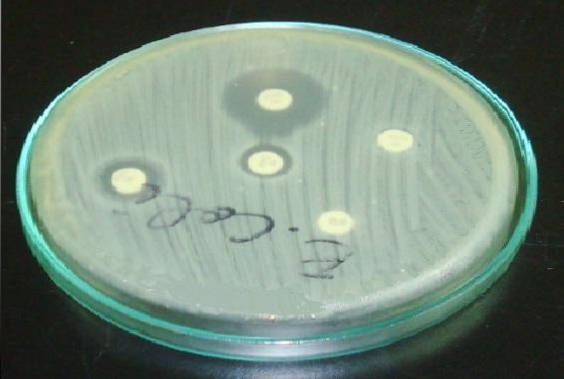
În Staphylococcus este important să plasați discul de eritromicină sau azitromicină în fața discului de clindamicină (test D).
Un halou rezistent în eritromicină și o aplatizare în halou de clindamicină indică faptul că tulpina posedă rezistență la clindamicină indusă de tulpină (ICR). Aceasta înseamnă că un tratament cu clindamicină nu va fi eficient..
Pentru a căuta tulpini AMP C inductibile în Enterobacteriaceae și unele tije Gram negative care nu fermentează, discurile ceftazidime, cefoxitină sau piperacilină tazobactan sunt confruntate împotriva unui disc imipenem, la o distanță de 27 mm.
Un halou aplatizat pe unul dintre discurile cu care se confruntă imipenem indică prezența C AMP inductibil.
Pentru căutarea C-AMP constitutivă, un disc de 500 µg cloxacilină este confruntat cu ceftazidimă (30 µg) și cu cefotaximă (30 µg), la o distanță de 25 mm. Un halou lărgit în oricare dintre cefalosporine indică pozitivitate.
Discul de cloxacilină poate fi de asemenea înlocuit cu un disc de 9 mm din hârtie de filtru Whatman nr. 6 impregnată cu acid fenil boric (400 µg) cu o distanță de 18 mm. Este interpretat la fel ca și cel precedent.
În cele din urmă, să investigheze producția de metalobetalactamaze în special în Pseudomonas aeruginosa, Se utilizează un disc impregnat cu 10 µl de acid etilendiaminetetraacetic (EDTA 750 µg) și acid tioglicolic (SMA 300 µg), care se confruntă cu discurile imipenem și meropenem, la o distanță de 15 mm.
Testul este pozitiv dacă există lărgirea halogenelor imipenem sau meropenem către discul EDTA / SMA. Acest rezultat trebuie confirmat prin testul Hodge modificat..
Această metodă constă în inocularea unei tulpini de Escherichia coli ATCC 25922 pe placa Müeller Hinton. Un disc de imipenem este plasat în centrul plăcii și apoi se face o dungă din disc către periferie cu tulpina de P. aeruginosa suspicios. Se pot testa până la 4 tulpini pe placă.
Testul va fi pozitiv dacă există o zonă de distorsiune a halo imipenem în jurul vergetului.
Cauze ale rezultatelor eronate
-Discurile antibiotice slab conservate pot produce rezistență falsă. De exemplu, discul de oxacilină este foarte vulnerabil la schimbările de temperatură..
-Un pH al mediului sub cel indicat (acid) produce halouri mai mici în aminoglicozide și macrolide (risc de falsă rezistență) și halouri mai mari în penicilină, tetraciclină și novobiocină (risc de falsă sensibilitate).
-Dacă pH-ul este peste cel indicat (alcalin), efectele descrise mai sus sunt inversate.
-Mediile cu concentrații crescute de timină și timidină au o influență prin reducerea semnificativă a halourilor de inhibare a sulfonamidelor și trimetoprimului..
-Concentrațiile mari de calciu și magneziu produc o rezistență falsă a aminoglicozidelor, polimixinei B și a tetraciclinelor împotriva tulpinilor de Pseudomonas aeruginosa.
-Concentrațiile scăzute de calciu și magneziu produc false sensibilități ale aminoglicozidelor, polimixinei B și tetraciclinelor împotriva tulpinilor de Pseudomonas aeruginosa.
-Prezența zincului afectează rezultatele discurilor carbapenemice (imipenem, meropenem și ertapenem).
-Grosimea suportului sub 3 mm va produce rezultate de sensibilitate falsă, în timp ce grosimea peste 5 va produce rezistență falsă.
-Mobilizarea discurilor în antibiogramă va da halouri deformate, deoarece descărcarea antibioticelor este imediată.
- Inoculurile foarte slabe afectează rezultatele, deoarece nu va exista o creștere uniformă sau confluentă în agar, o condiție necesară pentru a putea măsura halourile de inhibare, pe lângă faptul că halourile pot da mai mult decât în mod normal.
-Inoculele prea încărcate pot da halouri mai mici decât cele normale.
-Nerespectarea distanței dintre discuri face ca un halou să se suprapună cu altul și nu pot fi citite corect.
-Se incubează cu CODouă mărește dimensiunea halourilor discurilor de tetraciclină și meticilină.
-Incubarea la temperaturi sub 35 ° C produce halouri mai mari.
-Adăugarea de sânge scade dimensiunea halo sulfonamidei.
Prescripţie
Sensibilitatea unui antibiotic demonstrată în antibiogramă împotriva unui microorganism (in vitro) nu garantează că va funcționa in vivo.
QA
Pentru a ști dacă mediul conține cantitatea adecvată de timină, trebuie cultivată o tulpină Enterococcus faecalis ATCC 29212 și testează sensibilitatea la trimetoprim sulfametoxazol (SXT), trebuie să dea un halou egal sau> 20 mm pentru a fi satisfăcător.
Referințe
- „Agar Müller-Hinton”. Wikipedia, enciclopedia gratuită. 16 noiembrie 2018, 12:23 UTC. 27 ianuarie 2019, 04:22
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnosticul microbiologic Bailey & Scott. 12 ed. Editorial Panamericana S.A. Argentina.
- Cona E. Condiții pentru un bun studiu de susceptibilitate prin test de difuzie agar. Rev Chil Infect, 2002; 19 (2): 77-81
- Laboratorul Difco Francisco Soria Melguizo. Agar Müeller Hinton cu 5% sânge de oaie. 2009. Disponibil la: http://f-soria.es
- Laboratorul de agar BD Müeller Hinton II. 2017. Disponibil la: .bd.com
- Laboratoarele Britannia. Agar Müeller Hinton. 2015. Disponibil la: britanialab.com
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosticul microbiologic. A 5-a ed. Editorial Panamericana S.A. Argentina.
- Martínez-Rojas D. Betalactamaze de tip AmpC: Generalități și metode pentru detectarea fenotipică. Pr. Soc. Ven. Microbiol. 2009; 29 (2): 78-83. Disponibil la: scielo.org.
- Perozo A, Castellano M, Ling E, Arraiz N. Detectarea fenotipică a metalobetalactamazelor în izolatele clinice ale Pseudomonas aeruginosa. Kasmera, 2012; 40 (2): 113-121. Disponibil la: scielo.org.


Nimeni nu a comentat acest articol încă.