
Structura anisolului, proprietăți, nomenclatură, riscuri și utilizări
anisol sau metoxibenzen este un compus organic format dintr-un eter aromatic a cărui formulă chimică este C6H5OCH3. Starea sa fizică este aceea a unui lichid incolor, care poate prezenta colorații gălbui. Este ușor de recunoscut prin mirosul său caracteristic de anason.
Este apoi un compus volatil și forțe de coeziune nu foarte mari; caracteristicile tipice ale eterilor ușori, care sunt depozitați în recipiente mici sigilate. Mai exact, anizolul este cel mai simplu dintre eterii alchil arii; adică cele cu un component aromatic (Ar) și un alt component alchil (R), Ar-O-R.
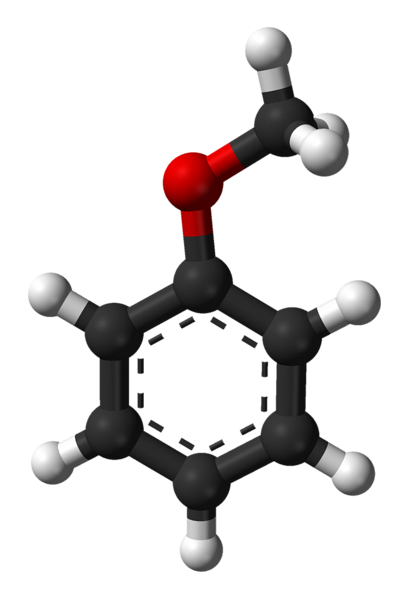
Grupa C6H5- vine să denote Ar și -CH3 la R, având astfel C6H5-O-CH3. Inelul aromatic și prezența -OCH3 Ca grupare substituentă numită metoxi, conferă anisolului o nucleofilicitate superioară celei a benzenului și a nitrobenzenului. Prin urmare, servește ca o moleculă intermediară pentru sinteza compușilor cu activitate farmacologică..
Mirosul său caracteristic de anason a fost folosit pentru a adăuga anisol produselor cosmetice și de igienă care necesită un parfum plăcut..
Indice articol
- 1 Structura anisolului
- 1.1 Momentul dipol
- 1.2 Cristale
- 2 Proprietăți
- 2.1 Aspect fizic
- 2.2 Miros
- 2.3 Aromă
- 2.4 Masa moleculară
- 2.5 Densitate
- 2.6 Densitatea vaporilor
- 2.7 Punctul de topire
- 2.8 Punctul de fierbere
- 2.9 Punct de aprindere
- 2.10 Temperatura de autoinflamare
- 2.11 Vâscozitatea
- 2.12 Tensiunea superficială
- 2.13 Indicele de refracție
- 2.14 Solubilitate
- 2.15 nucleofilicitate
- 2.16 Reactivitate
- 3 Nomenclatură
- 4 Riscuri
- 5 utilizări
- 5.1 Sinteze organice
- 5.2 Parfumuri
- 6 Referințe
Structura anisolului
Imaginea superioară arată structura moleculară a anisolului utilizând un model de sfere și bare. Este apreciat inelul aromatic, ai cărui carboni sunt spDouă și, prin urmare, este plat, ca o foaie hexagonală; și atașată de aceasta este gruparea metoxi, al cărei carbon este sp3, iar hidrogenii săi sunt deasupra sau sub planul inelar.
Importanța grupului -OCH3 în structură depășește ruptura cu geometria plană a moleculei: îi conferă polaritate și, în consecință, molecula apolară a benzenului capătă un moment dipol permanent.
Momentul dipol
Acest moment dipolar se datorează atomului de oxigen, care atrage densitățile electronice atât ale inelelor aromatice, cât și ale inelului metilic. Datorită acestui fapt, moleculele de anizol pot interacționa prin forțe dipol-dipol; Deși, îi lipsește orice posibilitate de a forma legături de hidrogen, deoarece este un eter (ROR nu are H legat de oxigen).
Punctul său ridicat de fierbere (154 ° C), certifică experimental interacțiunile intermoleculare puternice care guvernează lichidul său. De asemenea, sunt prezente forțele de dispersie din Londra, dependente de masa moleculară și de interacțiunile π-π dintre inele..
Cristale
Cu toate acestea, structura anisolului nu îi permite să interacționeze suficient de puternic pentru a adopta un solid la temperatura camerei (mp = -37 ° C). Acest lucru se poate datora și faptului că, atunci când distanțele intermoleculare sunt reduse, repulsiile electrostatice dintre electronii inelelor aromatice învecinate încep să câștige multă forță..
Prin urmare, și conform studiilor cristalografice, moleculele de anizol din cristale la o temperatură de -173ºC nu pot fi aranjate în așa fel încât inelele lor să fie orientate una față de cealaltă; adică centrele lor aromatice nu sunt aliniate una peste alta, ci mai degrabă un grup -OCH3 este deasupra sau sub un inel vecin.
Proprietăți
Aspectul fizic
Lichid incolor dar care poate avea tonuri ușoare de culoare paie.
Miros
Miroase ușor asemănător cu semințele de anason.
Gust
Bomboane; cu toate acestea, este moderat toxic, deci acest test este periculos.
Masa moleculara
108,140 g / mol.
Densitate
0,995 g / ml.
Densitatea vaporilor
3,72 (relativ la aer = 1).
Punct de topire
-37ºC.
Punct de fierbere
154ºC.
punctul de aprindere
125ºC (cupă deschisă).
temperatură de autoaprindere
475ºC.
Viscozitate
0,778 cP la 30 ° C.
Tensiune de suprafata
34,15 dynes / cm la 30ºC.
Indicator de refracție
1.5179 la 20 ° C.
Solubilitate
Solubil slab în apă (aproximativ 1 mg / ml). În alți solvenți, cum ar fi acetonă, eteri și alcooli, este totuși foarte solubil.
Nucleofilicitate
Inelul aromatic al anisolului este bogat în electroni. Acest lucru se datorează faptului că oxigenul, în ciuda faptului că este un atom extrem de electronegativ, contribuie cu electronii din norul său π pentru a-i delocaliza prin inel în numeroase structuri de rezonanță. În consecință, mai mulți electroni călătoresc prin sistemul aromatic și, prin urmare, nucleofilitatea acestuia crește..
Creșterea nucleofilicității a fost demonstrată experimental prin compararea reactivității sale, împotriva substituțiilor electrofile aromatice, cu cea a benzenului. Astfel, se evidențiază efectul remarcabil al grupului -OCH.3 asupra proprietăților chimice ale compusului.
De asemenea, trebuie remarcat faptul că substituțiile electrofile apar în pozițiile adiacente (-orto) și opuse (-para) grupării metoxi; adică este director orto-para.
Reactivitate
Nucleofilicitatea inelului aromatic al anizolului permite deja o privire asupra reactivității sale. Substituțiile pot apărea fie în inel (favorizat de nucleofilicitatea acestuia), fie în gruparea metoxi în sine; în acesta din urmă legătura O-CH este ruptă3 pentru a înlocui -CH3 printr-o altă grupare alchil: O-alchilare.
Prin urmare, într-un proces de alchilare, anizolul poate accepta o grupare R (fragmentul unei alte molecule) prin substituirea unui H pe inelul său (alchilare C) sau prin substituirea CH3 a grupării sale metoxi. Următoarea imagine ilustrează ceea ce tocmai a fost spus:
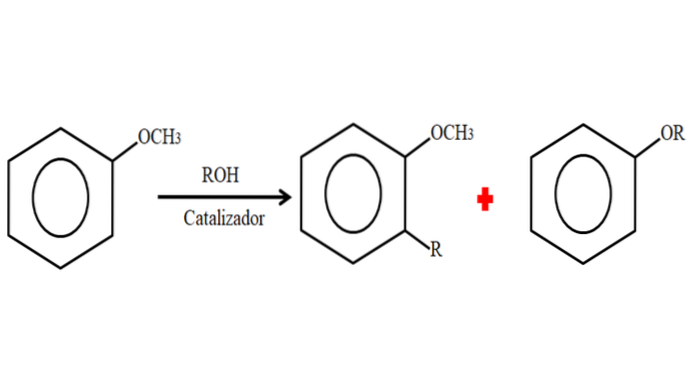
În imagine, grupul R este situat în poziția -orto, dar poate fi și în poziția -para, opusă lui -OCH3. Când se întâmplă O-alchilarea, se obține un nou eter cu o altă grupare -OR.
Nomenclatură
Numele de „anisol” este cel mai cunoscut și cel mai acceptat, cel mai probabil derivat din mirosul său de anason. Cu toate acestea, denumirea de „metoxibenzen” este destul de specifică, deoarece stabilește deodată care este structura și identitatea acestui eter aromatic; acesta este numele guvernat de nomenclatura sistematică.
Un alt nume mai puțin utilizat, dar la fel de valid este „fenil metil eter”, care este guvernat de nomenclatura tradițională. Acesta este probabil cel mai specific nume, deoarece indică în mod direct care sunt cele două porțiuni structurale ale eterului: fenil-O-metil, C6H5-O-CH3.
Riscuri
Studiile medicale nu au reușit încă să demonstreze posibilele efecte mortale ale anisolului în organism la doze mici. Cu toate acestea, la fel ca aproape toate substanțele chimice, provoacă iritații atunci când sunt expuse prea mult timp și în concentrații moderate pe piele, gât, plămâni și ochi..
De asemenea, datorită nucleofilicității inelului său, o parte din acesta este metabolizată și, prin urmare, este biodegradabilă. De fapt, ca urmare a acestei proprietăți, simulările au arătat că nu se poate concentra în ecosisteme apoase, deoarece organismele sale o degradează mai întâi; și, prin urmare, râurile, lacurile sau mările pot acumula anisol.
În soluri, dată fiind volatilitatea sa, se evaporă rapid și este dus de curenții de aer; fiind așa, nici nu afectează considerabil masele vegetale sau plantațiile.
Pe de altă parte, atmosferic reacționează cu radicalii liberi și, prin urmare, nu reprezintă un risc de contaminare pentru aerul pe care îl respirăm..
Aplicații
Sinteze organice
Din anisol pot fi obținuți alți derivați prin substituție electrofilă aromatică. Acest lucru face posibil ca acesta să fie utilizat ca intermediar pentru sinteza medicamentelor, pesticidelor și solvenților, la care se dorește adăugarea caracteristicilor sale. Căile sintetice pot consta în principal din C-alchilare sau O-alchilare.
Parfumuri
Pe lângă utilizarea sa pentru sinteza organică, poate fi utilizat direct ca aditiv pentru creme, unguente și parfumuri, încorporând parfumuri de anason la astfel de produse..
Referințe
- Morrison, R. T. și Boyd, R, N. (1987). Chimie organica. Ediția a V-a. Editorial Addison-Wesley Interamericana.
- Carey F. A. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (Ediția a X-a.). Wiley plus.
- Centrul Național pentru Informații despre Biotehnologie. (2019). Anisol. Baza de date PubChem, CID = 7519. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Anisol. Recuperat de pe: en.wikipedia.org
- Pereira, Cynthia C. M., de la Cruz, Marcus H. C. și Lachter, Elizabeth R. (2010). Alchilarea în fază lichidă a anizolului și fenolului catalizată de fosfat de niobiu. Jurnalul Societății Chimice din Brazilia, 21 (2), 367-370. dx.doi.org/10.1590/S0103-50532010000200025
- Seidel R. W. și Goddard R. (2015). Anisol la 100 K: prima determinare a structurii cristaline. Acta Crystallogr C Struct Chem. Aug; 71 (Pt 8): 664-6. doi: 10.1107 / S2053229615012553
- Formulare chimică. (2018). Metoxibenzen Recuperat de pe: formulacionquimica.com



Nimeni nu a comentat acest articol încă.