
Structura azidului de sodiu (NaN3), proprietăți, utilizări, riscuri

Azidă de sodiu este un solid anorganic cristalin format din ionul de sodiu Na+ iar ionul azidic N3-. Formula sa chimică este NaN3. Compusul NaN3 este sarea de sodiu a acidului hidrazoic HN3. NaN3 este un solid cristalin incolor până la alb.
Deși este un compus foarte toxic, una dintre cele mai răspândite utilizări a fost în sacii de aer care se umflă instantaneu în timpul accidentelor de vehicule. Este, de asemenea, utilizat pentru a umfla rapid diapozitive de urgență pe avioane. Cu toate acestea, utilizarea sa este în prezent extrem de pusă la îndoială în ambele cazuri datorită toxicității sale..

Este utilizat în laboratoarele de cercetare chimică pentru a sintetiza diverse tipuri de compuși și în laboratoarele biochimice pentru studii cu bacterii, ciuperci sau celule de mamifere sau umane.
În unele laboratoare este utilizat pentru sterilizarea materialelor sau echipamentelor, dar anumite tipuri de microorganisme rezistă acțiunii sale biocide.
De asemenea, a fost utilizat în agricultură pentru a elimina paraziții din sol sau în industria lemnului pentru a împiedica pătarea lemnului de pin cu ciuperci.
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Densitatea
- 3.5 Solubilitate
- 3.6 Constantele de disociere
- 3.7 Proprietăți chimice
- 3.8 Proprietăți biochimice
- 4 Obținerea
- 5 utilizări
- 5.1 La autovehicule și aeronave
- 5.2 În industria chimică
- 5.3 În agricultură
- 5.4 La prepararea altor compuși chimici
- 5.5 În industria explozivilor
- 5.6 În laboratoarele de biochimie
- 5.7 În diverse utilizări
- 6 Riscuri
- 7 Referințe
Structura
NaN azidă de sodiu3 este format dintr-un cation de sodiu Na+ și un anion azidic N3-.
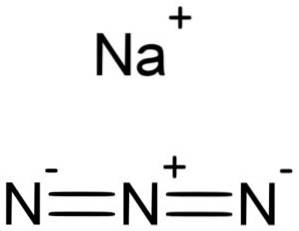
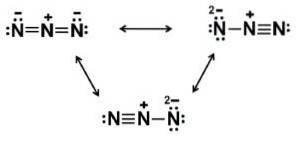
Ionul azidic N3- Este alcătuit din 3 atomi de azot (N) uniți prin legături covalente care pot fi simple, duble sau triple, deoarece electronii sunt împărțiți între cei trei.
Anionul menționat are o structură liniară, adică cei trei atomi de azot dispuși în linie dreaptă. În plus, structura este simetrică.
Nomenclatură
- Azidă de sodiu
- Azidă de sodiu
Proprietăți
Starea fizică
Solid cristalin incolor până la alb. Cristale hexagonale.
Greutate moleculară
65,01 g / mol
Punct de topire
Se descompune la 275 ºC.
Densitate
1,846 g / cm3 la 20 ° C
Solubilitate
Este foarte solubil în apă: 41,7 g / 100 ml la 17 ° C. Este ușor solubil în etanol și insolubil în eter etilic.
Constantele de disociere
Are un pKb din 9.3. Soluțiile apoase conțin NH3, care scapă rapid în mediu la 37 ° C.
Proprietăți chimice
NaN3 este foarte coroziv față de aluminiu și moderat față de cupru și plumb.
Potrivit unei anumite surse, azida de sodiu nu este explozivă. Se descompune ușor și complet atunci când este încălzit la 300 ° C sau mai mult, formând sodiu metal Na și azot gaz NDouă.
2 NaN3 → 2 Na + 3 NDouă↑
Este un agent de nitrurare, aceasta înseamnă că servește la azotarea sau adăugarea de azot la alți compuși chimici sau la suprafața materialelor precum oțelul..
Este stabil în apă neutră sau alcalină în absența luminii. Este descompus de radiația solară.
Proprietăți biochimice
Azida de sodiu inhibă o enzimă numită citocrom oxidază care se găsește în mitocondriile celulelor și este implicată semnificativ în respirație și generarea de energie în această.
Acțiunea sa previne generarea de ATP, un compus cheie în activitățile celulare, iar celula se deteriorează sau se deteriorează.
Dacă este ingerat, inhalat sau în contact cu azidă de sodiu, este foarte toxic și poate fi fatal..
Obținerea
Amoniacul NH reacționează3 cu sodiu metal Na la 350 ° C într-un recipient închis din oțel, obținând amida sodică NaNHDouă.
Amida de sodiu NaNHDouă se reacționează cu monoxid de dinitrogen NDouăSau la 230 ° C într-un reactor de nichel și astfel se formează un amestec de azidă de sodiu NaN3, hidroxid de sodiu NaOH și amoniac NH3.
2 NaNHDouă + NDouăO → NaN3 + NaOH + NH3
Poate fi obținut și prin reacția amidei de sodiu cu azotatul de sodiu NaNO3 la 175 ° C:
3 NaNHDouă + Frate mai mare3 → NaN3 + 3 NaOH + NH3
Pentru a purifica azida, se adaugă apă la amestec, cristalele de azidă sunt spălate și apoi apa este evaporată. Materialul cristalin rămas este azida de sodiu NaN3 care este apoi uscat la 110 ° C.
Aplicații
În autovehicule și aeronave
Azida de sodiu a fost folosită mult timp în industria auto ca generator de azot pentru umflarea rapidă a pungilor de aer. airbag-uri) siguranța volanelor mașinilor și camioanelor atunci când apare un impact.
De asemenea, a fost folosit în tobogane gonflabile care servesc la evadarea rapidă din interiorul avioanelor care au aterizat în situații de urgență..
În ambele cazuri, mecanismul implică acțiunea unei scântei pentru a produce o reacție imediată între azida de sodiu și anumiți compuși, generând azot gazos NDouă și oxid de sodiu NaDouăSAU.
În această aplicație, este necesară eliberarea instantanee a unui gaz rece și netoxic, deci azotul este cel mai potrivit gaz..

Cu toate acestea, această utilizare este în scădere din cauza toxicității azidei de sodiu și se folosesc în schimb compuși mai puțin toxici..
În industria chimică
Este utilizat ca întârziat în fabricarea cauciucului burete, pentru a preveni coagularea stirenului sau latexului butadienic atunci când sunt depozitate în contact cu metale și pentru a descompune nitriții în prezența nitraților.
În agricultură
A fost folosit în agricultură: ca biocid și fumigant, este și un nematicid, adică este aplicat pe soluri pentru a elimina nematodele, care sunt paraziți care atacă unele culturi.

De asemenea, a funcționat ca erbicid și pentru a preveni putregaiul fructelor.
Recent, NaN3 a fost utilizat la prepararea semințelor de okra sau de okra pentru a observa rezistența lor la condițiile de îmbătrânire.
Semințe la care s-a aplicat anterior NaN3 a generat răsaduri care au rezistat condițiilor de inundații mai bine decât cele netratate, au îmbunătățit înălțimea plantelor, au mărit numărul de frunze și au crescut numărul de rădăcini chiar și cu exces de apă.
La prepararea altor compuși chimici
Se folosește ca reactiv chimic în sinteza compușilor organici, de exemplu pentru a prepara multe azide organice, cum ar fi tosil azidă sau azide ale grupărilor terțe alchil, care sunt importante în sinteza chimică.
Se utilizează pentru prepararea acidului hidrazoic (HN3) și sodiu pur (Na).
În industria explozivilor
NaN azidă de sodiu3 este un intermediar în fabricarea explozivilor, deoarece este utilizat pentru prepararea azidei de plumb Pb (N3)Două. Acesta din urmă este un compus care explodează când este lovit cu forță, motiv pentru care este utilizat în construcția dispozitivelor detonante..

În laboratoarele de biochimie
Azida de sodiu este utilizată atunci când este nevoie de echipament de laborator steril, deoarece este capabil să distrugă diferite tipuri de microorganisme.
Este un agent biocid. Cu toate acestea, unele surse indică faptul că unele tipuri de bacterii sunt rezistente la acțiunea sa..
Acest lucru se realizează prin blocarea situsului de legare a oxigenului în citocrom oxidaza, care este o enzimă implicată în procesul de producere a energiei unor microorganisme..
Este utilizat în contoare automate de sânge, de asemenea în selecția diferențială a bacteriilor și pentru conservarea soluțiilor de reactivi de laborator, deoarece împiedică dezvoltarea anumitor microorganisme.
În diverse utilizări
Azida de sodiu este utilizată în industria cherestelei pentru a preveni creșterea petelor maro de ciuperci pe lemnul de pin..
De asemenea, a fost folosit în industria berii japoneze pentru a preveni dezvoltarea unei ciuperci care întunecă berea..
Riscuri
Azida de sodiu este un compus toxic care inhibă o enzimă importantă pentru respirație și viața celulelor umane și animale. S-a constatat că poate afecta grav celulele țesutului vaselor de sânge ale creierului.
Efectul său imediat după ingestie, inhalare sau contact cu pielea este scăderea periculoasă a tensiunii arteriale, ceea ce poate duce la moarte. Prin urmare, trebuie tratat cu mare prudență..
Există surse de informații care atrag atenția asupra airbagurilor vehiculelor care sunt distruse în zonele de deșeuri.
În astfel de cazuri, persoanele care nu sunt conștiente de pericol ar putea accesa depozitele NaN.3, acesta fiind un compus foarte toxic. În plus, există pericolul contaminării cu NaN3 sol și apă.
La fel, în timpul accidentelor, coliziunilor sau incendiilor vehiculelor, oamenii ar putea fi expuși la NaN3 iar acest lucru poate fi subestimat sau necunoscut de către personalul medical care participă la urgență.
De asemenea, a fost atrasă atenția asupra expunerii personalului de laborator care îl utilizează.
Referințe
- Vwioko, E.D. și colab. (2019). Amorsarea cu azidă de sodiu îmbunătățește toleranța la stres în apariția apei în Okra (Abelmoschus esculentus). Agronomie 2019, 9, 670. Recuperat de pe mdpi.com.
- Kho, D.T. și colab. (2017). Moartea celulelor endoteliale ale barierei cerebrale din sânge la azida de sodiu și produsele sale gazoase. Biosenzori 2017, 7, 41. Recuperat de pe mdpi.com.
- S.U.A. Biblioteca Națională de Medicină. (2019). Azidă de sodiu. Recuperat de la: pubchem.ncbi.nlm.nih.gov.
- Talavera, M. și colab. (2019). Managementul nematodelor în câmpurile de căpșuni din sudul Spaniei. Agronomie 2019, 9, 252. Recuperat de pe mdpi.com.
- Okano, T. și colab. (o mie noua sute nouazeci si cinci). Mecanismul detașării celulei de suprafețele polimerice hidrofile-hidrofobe modulate de temperatură. În Biomaterialele: Compendiul jubileului de argint. Recuperat de la sciencedirect.com.
- Enciclopedia lui Ullmann de chimie industrială. (1990). Ediția a cincea. Volumul A22. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.
- Chang, S. și Lamm, S.H. (2003). Efectele asupra sănătății umane ale expunerii la azidă de sodiu: o revizuire și o analiză a literaturii. Int J Toxicol 2003, 22 (3): 175-86. Recuperat de la ncbi.nlm.nih.gov.



Nimeni nu a comentat acest articol încă.