
Structura oxalatului de sodiu (Na2C2O4), proprietăți, utilizări, riscuri
oxalat de sodiu Este un compus organic format din doi ioni de sodiu și un ion oxalat. Formula sa chimică este NaDouăCDouăSAU4 sau, de asemenea, NaDouă(GÂNGURI)Două. Este sarea de sodiu a acidului oxalic sau a acidului etandioic. Apoi oDouăCDouăSAU4 este un solid cristalin alb și soluțiile sale apoase sunt bazice (alcaline).
Oxalatul de sodiu este prezent în plante și legume. La om, acidul oxalic este generat în mod natural din acidul conjugat, care la rândul său este produs de anumite procese metabolice.

Apoi oDouăCDouăSAU4 Este utilizat în laboratoarele de analiză chimică ca agent reducător (opusul oxidantului). De asemenea, pentru a permite testarea anumitor compuși organici în timpul epurării apelor uzate.
A fost utilizat pentru eliminarea deșeurilor de clorofluorocarburi (CGC), care deteriorează stratul de ozon. Este, de asemenea, o materie primă pentru a obține acid oxalic economic.
Datorită conținutului ridicat de oxalat de sodiu al unor legume comestibile, persoanele care au tendința de a forma pietre sau pietre la rinichi ar trebui să evite consumul de astfel de alimente. Acest lucru se datorează faptului că pietrele sunt de obicei formate cu oxalați..
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Densitatea
- 3.4 Solubilitate
- 3,5 pH
- 3.6 Proprietăți chimice
- 4 Obținerea
- 4.1 Prezența în natură
- 5 utilizări
- 5.1 În laboratoarele de analiză chimică
- 5.2 În distrugerea clorofluorocarburilor
- 5.3 La determinarea parametrilor importanți în tratarea apelor uzate
- 5.4 Pentru a obține acid oxalic
- 5.5 Pentru a elimina compușii nedoriti
- 6 Riscuri
- 7 Referințe
Structura
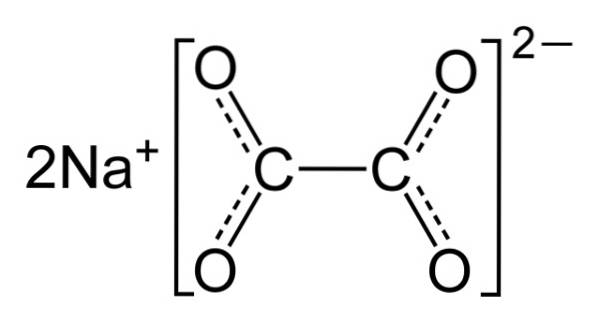
Oxalatul de sodiu este alcătuit din doi cationi de sodiu Na+ și un anion oxalat (COO)DouăDouă-. Anionul oxalat este la rândul său format din două unități COO- legat prin cei doi atomi de carbon: -OOC-COO-.
În oxalatul de sodiu solid, anionul oxalat are o formă plană. Aceasta înseamnă că atât carbonii cât și oxigenii se află în același plan..
Nomenclatură
- Oxalat de sodiu
- Oxalat disodic
- Sare de sodiu a acidului etandioic
Proprietăți
Starea fizică
Cristal alb solid.
Greutate moleculară
134,0 g / mol
Densitate
2,27 g / cm3 la 20 ° C.
Solubilitate
Solubil în apă: 3,7 g / 100 ml la 20 ° C.
pH
Soluțiile sale apoase sunt de bază (alcaline) deoarece anionul oxalat tinde să ia protoni din apă, lăsând ionii OH liberi.-.
Proprietăți chimice
Poate neutraliza acizii și reacțiile sunt exoterme, adică degajă căldură.
Acesta servește ca agent de reducere și în aceste reacții generează dioxid de carbon CODouă.
Are proprietatea de a se lega puternic de diverși ioni metalici, cum ar fi ioni de fier feros FeDouă+ și Fe feric3+.
Obținerea
Potrivit unei surse consultate, oxalatul de sodiu poate fi obținut prin oxidarea carbonului cu oxigen ODouă la o temperatură de aproximativ 250 ° C într-o soluție concentrată de hidroxid de sodiu NaOH.
Prezență în natură
Oxalatul de sodiu este prezent în numeroase plante și legume, cum ar fi brad, spanac și rubarbă, și în cereale precum soia, printre multe alte produse vegetale..

Acidul său conjugat, acidul oxalic, este produs în corpul uman prin metabolismul acidului glicolic sau al acidului ascorbic. Odată produs, nu este metabolizat, ci este excretat în urină sub formă de oxalat..

Aplicații
În laboratoarele de analize chimice
Este utilizat ca reactiv chimic, în general ca agent de reducere, de exemplu pentru standardizarea soluțiilor de permanganat de potasiu, adică pentru a determina exact cât de mult permanganat de sodiu au.
În distrugerea clorofluorocarburilor
Oxalatul de sodiu a fost utilizat pentru distrugerea clorofluorocarburilor (CFC). Acești compuși CFC au fost unul dintre cei responsabili de distrugerea stratului de ozon al planetei (care ne protejează de radiațiile ultraviolete).
În 1996, unii cercetători au propus utilizarea oxalatului de sodiu pentru a le elimina, deoarece reacționează cu ușurință cu CFC la temperaturi de 270-290 ° C, făcându-i inofensivi pentru stratul de ozon..
Reacția oxalatului de sodiu cu CFC poate fi controlată pentru a obține hidrocarburi aromatice halogenate care nu sunt nocive pentru stratul de ozon, dar sunt compuși utili în industria chimică..
Respectiva reacție poate fi, de asemenea, maximizată și transformă tot CFC în fluorură de sodiu NaF, clorură de sodiu NaCl, carbon elementar și dioxid de carbon CO.Două.

La determinarea parametrilor importanți în epurarea apelor uzate
S-a dovedit că oxalatul de sodiu este util în măsurarea cantității și tipurilor de compuși organici secretați de microorganisme din nămolul utilizat pentru tratarea apelor uzate..
Măsurarea acestor compuși este importantă pentru a determina funcția lor în timpul epurării apelor uzate, deoarece ușurința de a separa nămolul de apă depinde de acestea..
Utilizarea oxalatului de sodiu evită dezavantajele altor metode.
Pentru a obține acid oxalic
Oxalatul de sodiu brut din anumite deșeuri de proces a fost utilizat pentru a produce acid oxalic HDouăCDouăSAU4 în cantități mari.
Metoda folosește nămoluri din procesul Bayer pentru a trata bauxita (un minereu de aluminiu). În procesul Bayer, bauxita este tratată cu hidroxid de sodiu NaOH pentru a dizolva alumina acestui mineral.
În procesul de dizolvare a aluminei, anumiți compuși organici prezenți în mineral, cum ar fi acizii humici, sunt atacați de NaOH, generând o cantitate mare de oxalat de sodiu NaDouăCDouăSAU4.
Acest oxalat de sodiu este încorporat într-un noroi cu compuși de aluminiu. Pentru a-l purifica, întregul este dizolvat, filtrat și trecut printr-o coloană de schimb ionic de tip acid..
În coloană este o rășină de acid sulfonic RSO3H unde se schimbă ioni metalici Na+ de ioni de hidrogen H+, deci obțineți acid oxalic HDouăCDouăSAU4.
RSO3H + NaDouăCDouăSAU4 ⇔ RSO3Na + NaHCDouăSAU4
RSO3H + NaHCDouăSAU4 ⇔ RSO3Na + HDouăCDouăSAU4
Acesta este un proces ieftin, iar acidul oxalic obținut are o puritate acceptabilă..
Pentru a elimina compușii nedoriti
Acid conjugat de oxalat de sodiu, acid oxalic HDouăCDouăSAU4, folosit pentru a dizolva anumite tipuri de resturi și solzi.
Profită de caracteristica acidului oxalic pentru a se transforma în oxalat care acționează ca agent de complexare sau de precipitare, de exemplu în timpul procesării deșeurilor din diferiți combustibili nucleari.
Acidul oxalic este, de asemenea, utilizat pentru îndepărtarea reziduurilor minerale și a oxidului de fier din țevi și alte echipamente, acest lucru se datorează capacității sale de a lega puternic atât ionul feros FeDouă+ în ceea ce privește ionul feric Fe3+ formând oxalați.
Riscuri
Dacă inhalat sau ingerat direct oxalatul de sodiu provoacă dureri în gât, esofag și stomac. Produce vărsături, purjare severă, puls slab, colaps cardiovascular, simptome neuromusculare și leziuni renale.
Persoanele care au tendința de a forma pietre la rinichi datorită acumulării de oxalat în urină ar trebui să evite consumul de legume cu un conținut ridicat de oxalați solubili precum sodiul.
Oxalatul de sodiu în cantități mari în alimente atunci când ajunge în urină, se leagă de calciu prezent în acesta și poate provoca pietre sau pietre de oxalat de calciu la rinichi la persoanele care au tendința de a face acest lucru..
Referințe
- S.U.A. Biblioteca Națională de Medicină. (2019). Oxalat de sodiu. Centrul Național pentru Informații despre Biotehnologie. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Chai, W. și Liebman, M. (2005). Efectul diferitelor metode de gătit asupra conținutului de oxalat de legume. J. Agric. Food Chem.2005, 53, 3027-3030. Recuperat de la pubs.acs.org.
- Dagani, R. (1996). Reacția de distrugere a CFC. Arhivă de știri chimică și inginerie 1996, 74, 4, 6-7. Recuperat de la pubs.acs.org.
- Sajjad, M. și Kim, K.S. (2016). Extracția substanțelor polimerice extracelulare din nămol activat folosind oxalat de sodiu. Int. J. Environ. Știință tehnologică. 13, 1697-1706 (2016). Recuperat de pe link.springer.com.
- Jeffrey, G.A. și Parry, G.S. (1954). Structura cristalină a oxalatului de sodiu. J. Am. Chem. Soc. 1954, 76, 21, 5283-5286. Recuperat de la pubs.acs.org.
- Okuwaki, A. și colab. (1984). Producerea de oxalat prin oxidarea cărbunelui cu oxigen într-o soluție concentrată de hidroxid de sodiu. Ind. Ing. Chem. Prod. Res. Dev. 1984, 23, 648-651. Recuperat de la pubs.acs.org.
- Hefter, G. și colab. (2018). Solubilitatea oxalatului de sodiu în soluții concentrate de electroliți. J Chem & Eng Data. 2018, 63, 3, 542-552. Recuperat de la pubs.acs.org.
- The, K. I. (1992). Procedeu de preparare a acidului oxalic și a hidrogen oxalatului de sodiu din oxalatul de sodiu brut. S.U.A. Brevetul nr. 5.171.887. 15 decembrie 1992. Recuperat de pe freepatentsonline.com.



Nimeni nu a comentat acest articol încă.