
Baze și exemple caracteristice

baze sunt toți acei compuși chimici care pot accepta protoni sau pot dona electroni. În natură sau artificial există atât baze anorganice, cât și baze organice. Prin urmare, comportamentul său poate fi prezis pentru multe molecule ionice sau solide..
Cu toate acestea, ceea ce diferențiază o bază de restul substanțelor chimice este tendința sa marcată de a dona electroni în comparație cu, de exemplu, speciile cu densitate mică de electroni. Acest lucru este posibil numai dacă perechea electronică este localizată. În consecință, bazele au regiuni bogate în electroni, δ-.

Ce proprietăți organoleptice permit identificarea bazelor? În general sunt substanțe caustice, care cauzează arsuri severe prin contact fizic. În același timp, au o atingere cu săpun și dizolvă cu ușurință grăsimile. În plus, aromele sale sunt amare.
Unde sunt ei în viața de zi cu zi? O sursă comercială și de rutină de fundații sunt produsele de curățare, de la detergenți la săpunuri de mână. Din acest motiv, imaginea bulelor suspendate în aer poate ajuta la amintirea bazelor, chiar dacă în spatele lor există multe fenomene fizico-chimice implicate..
Multe baze prezintă proprietăți total diferite. De exemplu, unele au mirosuri puternice și puternice, cum ar fi aminele organice. Altele, pe de altă parte, cum ar fi amoniacul, sunt penetrante și iritante. De asemenea, pot fi lichide incolore sau solide albe ionice..
Cu toate acestea, toate bazele au un lucru în comun: reacționează cu acizii pentru a produce săruri solubile în solvenți polari, cum ar fi apa..
Indice articol
- 1 Caracteristicile bazelor
- 1.1 Proprietăți fizice
- 1.2 Rezistența unei baze
- 1,3 pH mai mare de 7
- 1.4 Capacitatea de a neutraliza acizii
- 1.5 Capacitatea de reducere a oxidului
- 1.6 Eliberați OH-
- 1.7 Au atomi de azot sau substituenți care atrag densitatea electronilor
- 2 Exemple de baze
- 2.1 NaOH
- 2.2 CH3OCH3
- 2.3 Hidroxizi alcalini
- 2.4 Bazele organice
- 2,5 NaHCO3
- 3 Referințe
Caracteristicile bazelor

În afară de cele menționate deja, ce caracteristici specifice ar trebui să aibă toate bazele? Cum pot accepta protoni sau dona electroni? Răspunsul constă în electronegativitatea atomilor moleculei sau ionului; iar dintre toate, oxigenul este predominant, mai ales atunci când se găsește ca ion hidroxil, OH-.
Proprietăți fizice
Bazele au un gust acru și, cu excepția amoniacului, sunt inodore. Textura sa este alunecoasă și are capacitatea de a schimba culoarea hârtiei de turnesol în albastru, metil portocaliu în galben și fenolftaleină în violet..
Rezistența unei baze
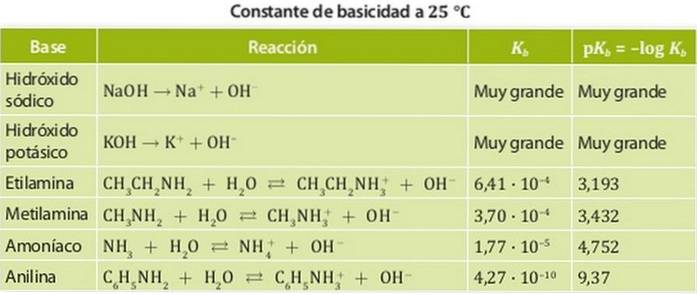
Bazele sunt clasificate în baze puternice și baze slabe. Puterea unei baze este asociată constantei sale de echilibru, prin urmare, în cazul bazelor, aceste constante se numesc constante de basicitate Kb.
Astfel, bazele puternice au o constantă mare de basicitate, astfel încât tind să se disocieze complet. Exemple de acești acizi sunt alcalii, cum ar fi hidroxidul de sodiu sau potasiu, ale cărui constante de bazicitate sunt atât de mari încât nu pot fi măsurate în apă..
Pe de altă parte, o bază slabă este una a cărei constantă de disociere este scăzută, deci se află în echilibru chimic.
Exemple de acestea sunt amoniacul și aminele ale căror constante de aciditate sunt de ordinul 10-4. Figura 1 arată diferitele constante de aciditate pentru diferite baze.
pH mai mare de 7
Scara pH-ului măsoară alcalinitatea sau nivelul de aciditate al unei soluții. Scara variază de la zero la 14. Un pH mai mic de 7 este acid. Un pH mai mare de 7 este de bază. Punctul mediu 7 reprezintă un pH neutru. O soluție neutră nu este nici acidă, nici alcalină.
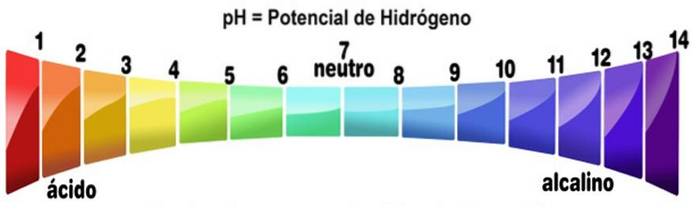
Scara pH-ului se obține în funcție de concentrația de H+ în soluție și este invers proporțională cu aceasta. Bazele, prin scăderea concentrației de protoni, măresc pH-ul unei soluții.
Capacitatea de a neutraliza acizii
Arrhenius, în teoria sa, propune că acizii, prin faptul că pot genera protoni, reacționează cu hidroxilul bazelor pentru a forma sare și apă în felul următor:
HCI + NaOH → NaCl + HDouăSAU.
Această reacție se numește neutralizare și stă la baza tehnicii analitice numită titrare..
Capacitate de reducere a oxidului
Având în vedere capacitatea lor de a produce specii încărcate, bazele sunt utilizate ca mediu pentru transferul de electroni în reacțiile redox..
Bazele au, de asemenea, tendința de a se oxida, deoarece au capacitatea de a dona electroni liberi..
Bazele conțin ioni OH. Ei pot acționa pentru a dona electroni. Aluminiu este un metal care reacționează cu baze.
2Al + 2NaOH + 6HDouăO → 2NaAl (OH)4+3HDouă
Ele nu corodează multe metale, deoarece metalele tind să piardă mai degrabă decât să accepte electroni, dar bazele sunt foarte corozive pentru substanțele organice precum cele care alcătuiesc membrana celulară..
Aceste reacții sunt de obicei exoterme, ceea ce provoacă arsuri severe la contactul cu pielea, astfel încât acest tip de substanță trebuie tratată cu grijă. Figura 3 este indicatorul de siguranță atunci când o substanță este corozivă.

Eliberează OH-
Pentru început, OH- Poate fi prezent în mulți compuși, în principal în hidroxizi metalici, deoarece în compania metalelor tinde să „smulgă” protoni pentru a forma apă. Astfel, o bază poate fi orice substanță care eliberează acest ion în soluție printr-un echilibru de solubilitate:
M (OH)Două <=> MDouă+ + 2OH-
Dacă hidroxidul este foarte solubil, echilibrul este deplasat în totalitate la dreapta ecuației chimice și vorbim despre o bază puternică. M (OH)Două , în schimb, este o bază slabă, deoarece nu eliberează complet ionii OH- in apa. Odată OH- produsul poate neutraliza orice acid din jurul său:
Oh- + HA => A- + HDouăSAU
Și astfel OH- deprotonează acidul HA pentru a se transforma în apă. De ce? Deoarece atomul de oxigen este foarte electronegativ și are și o densitate excesivă de electroni datorită sarcinii negative.
O are trei perechi de electroni liberi și poate dona pe oricare dintre aceștia către atomul H încărcat parțial pozitiv, δ +. La fel, marea stabilitate energetică a moleculei de apă favorizează reacția. Cu alte cuvinte: HDouăSau este mult mai stabil decât HA și, atunci când acest lucru este adevărat, va apărea reacția de neutralizare.
Conjugați bazele
Și ce zici de OH- deja-? Ambele sunt baze, cu diferența că A- este bază conjugată acid acid. Mai mult, A- este o bază mult mai slabă decât OH-. De aici se ajunge la următoarea concluzie: o bază reacționează pentru a genera una mai slabă.
Baza Puternic + Acid Puternic => Baza Slab + Acid Slab
După cum se poate observa din ecuația chimică generală, același lucru este valabil și pentru acizi.
Conjugați baza A- poate deprotona o moleculă într-o reacție cunoscută sub numele de hidroliză:
LA- + HDouăSAU <=> HA + OH-
Cu toate acestea, spre deosebire de OH-, stabilește un echilibru atunci când este neutralizat cu apă. Din nou, este pentru că A- este o bază mult mai slabă, dar suficientă pentru a produce o modificare a pH-ului soluției.
Prin urmare, toate acele săruri care conțin A- sunt cunoscute sub numele de săruri de bază. Un exemplu dintre acestea este carbonatul de sodiu, NaDouăCO3, care după dizolvare bazifică soluția prin reacția de hidroliză:
CO3Două- + HDouăSAU <=> HCO3- + Oh-
Au atomi de azot sau substituenți care atrag densitatea electronilor
O bază nu este doar solidele ionice cu anioni OH- în rețeaua lor cristalină, pot avea și alți atomi electronegativi precum azotul. Aceste tipuri de baze aparțin chimiei organice, iar printre cele mai comune sunt aminele.
Ce este grupul de amine? R-NHDouă. Pe atomul de azot există o pereche electronică nepartajată, care poate, precum și OH-, deprotonează o moleculă de apă:
R-NHDouă + HDouăSAU <=> RNH3+ + Oh-
Echilibrul este foarte deplasat spre stânga, deoarece amina, deși bazică, este mult mai slabă decât OH-. Rețineți că reacția este similară cu cea dată pentru molecula de amoniac:
NH3 + HDouăSAU <=> NH4+ + Oh-
Numai aminele nu pot forma în mod corespunzător cationul, NH4+; deși RNH3+ este cationul de amoniu cu o monosubstituție.
Și poate reacționa cu alți compuși? Da, cu oricine are hidrogen suficient de acid, chiar dacă reacția nu are loc complet. Adică, doar o amină foarte puternică reacționează fără a stabili un echilibru. La fel, aminele își pot dona perechea de electroni către alte specii decât H (cum ar fi radicalii alchil: -CH3).
Baze cu inele aromatice
Aminele pot avea și inele aromate. Dacă perechea sa de electroni poate fi „pierdută” în interiorul inelului, deoarece inelul atrage densitatea electronilor, atunci basicitatea acestuia va scădea. De ce? Deoarece perechea menționată este mai localizată în structură, cu atât va reacționa mai repede cu speciile sărace în electroni.
De exemplu, NH3 este de bază, deoarece perechea sa de electroni nu are încotro. La fel se întâmplă și cu aminele, indiferent dacă sunt primare (RNHDouă), secundar (RDouăNH) sau terțiar (R3N). Acestea sunt mai elementare decât amoniacul, deoarece, pe lângă ceea ce tocmai a fost explicat, azotul atrage densități electronice mai mari ale substituenților R, crescând astfel δ-.
Dar când există un inel aromatic, această pereche poate intra în rezonanță în interiorul său, făcând imposibilă participarea la formarea legăturilor cu H sau alte specii. Prin urmare, aminele aromatice tind să fie mai puțin bazice, cu excepția cazului în care perechea de electroni rămâne fixată pe azot (ca și în cazul moleculei de piridină).
Exemple de baze
NaOH
Hidroxidul de sodiu este una dintre cele mai utilizate baze la nivel mondial. Aplicațiile sale sunt nenumărate, dar printre acestea putem menționa utilizarea sa pentru saponificarea unor grăsimi și astfel fabricarea sărurilor bazice ale acizilor grași (săpunuri).
CH3OCH3
Structural, acetonă poate părea să nu accepte protoni (sau să doneze electroni), dar o face, chiar dacă este o bază foarte slabă. Acest lucru se datorează faptului că atomul electronegativ O atrage norii de electroni ai grupurilor CH.3, accentuând prezența celor două perechi de electroni (: O :).
Hidroxizi alcalini
În afară de NaOH, hidroxizii metalelor alcaline sunt și baze puternice (cu o ușoară excepție a LiOH). Astfel, printre alte baze există următoarele:
-KOH: hidroxid de potasiu sau potasiu caustic, este una dintre cele mai utilizate baze în laborator sau în industrie, datorită puterii sale mari de degresare.
-RbOH: hidroxid de rubidiu.
-CsOH: hidroxid de cesiu.
-FrOH: hidroxid de franciu, a cărui basicitate este teoretic presupusă a fi una dintre cele mai puternice cunoscute vreodată.
Baze organice
-CH3CHDouăNHDouă: etilamină.
-LiNHDouă: amidă de litiu. Împreună cu amida de sodiu, NaNHDouă, sunt una dintre cele mai puternice baze organice. În ele anionul amidic, NHDouă- este baza care deprotonează apa sau reacționează cu acizii.
-CH3ONa: metoxid de sodiu. Aici baza este anionul CH3SAU-, care poate reacționa cu acizi pentru a da metanol, CH3Oh.
-Reactivi Grignard: au un atom de metal și un halogen, RMX. În acest caz, radicalul R este baza, dar nu tocmai pentru că ia un hidrogen acid, ci pentru că renunță la perechea sa de electroni pe care o împarte cu atomul de metal. De exemplu: bromură de etilmagneziu, CH3CHDouăMgBr. Sunt foarte utile în sinteza organică.
NaHCO3
Bicarbonatul de sodiu este utilizat pentru a neutraliza aciditatea în condiții ușoare, de exemplu în interiorul gurii ca aditiv în pastele de dinți..
Referințe
- Merck KGaA. (2018). Bazele organice. Luat de pe: sigmaaldrich.com
- Wikipedia. (2018). Bazele (chimia). Luat de pe: es.wikipedia.org
- Chimie 1010. Acizi și baze: ce sunt și unde se găsesc. [PDF]. Luat din: cactus.dixie.edu
- Acizi, baze și scala pH-ului. Luat din: 2.nau.edu
- Grupul Bodner. Definiții ale acizilor și bazelor și rolul apei. Luat de la: chemed.chem.purdue.edu
- Chimie LibreTexte. Bazele: Proprietăți și exemple. Preluat de pe: chem.libretexts.org
- Shiver & Atkins. (2008). Chimie anorganică. Pe Acizi și baze. (a patra editie). Mc Graw Hill.
- Helmenstine, Todd. (04 august 2018). Numele a 10 baze. Recuperat de pe: thoughtco.com


Nimeni nu a comentat acest articol încă.