
Istoria, structura, proprietățile, derivații, utilizările benzenului
benzen Este un compus organic care constă dintr-unul dintre cele mai simple hidrocarburi aromatice dintre toate. Formula sa chimică este C6H6, dintre care se știe că raportul dintre carbon și hidrogen este egal cu 1; adică pentru fiecare carbon există un hidrogen legat de acesta.
Deși aspectul său fizic este acela al unui lichid incolor, acesta se găsește în mod natural în petrol și produse petroliere. Mirosul său este foarte caracteristic, deoarece seamănă cu un amestec de lipici, bitum și benzină; pe de altă parte, este un lichid volatil și inflamabil.

Imaginea de mai sus prezintă un recipient sau o sticlă cu benzen, probabil de puritate non-analitică. Dacă ar fi descoperite, vaporii de benzen s-ar răspândi imediat în laborator. Din acest motiv, acest lichid, utilizat în mod obișnuit ca solvent simplu, este manipulat în interiorul unei hote..
Fiind formula sa C6H6, chimiștii din secolul al XIX-lea au propus numeroase structuri posibile care să corespundă raportului C / H menționat egal cu 1. Nu numai acest lucru, dar molecula de benzen trebuia să aibă legături speciale în așa fel încât să se explice stabilitatea sa neobișnuită împotriva reacțiilor de adiție; tipic pentru alchene și poliene.
Astfel legăturile lor reprezentau o enigmă pentru chimiștii de atunci; până când proprietatea a sunat aromaticitate. Înainte de a fi considerat un hexaciclotrien (cu trei legături C = C), benzenul este mult mai mult decât atât și este un alt dintre numeroasele exemple de sinergie în chimie.
În chimia organică, benzenul este un simbol clasic, baza structurală pentru mai mulți compuși poliaromatici. Derivații fără sfârșit sunt obținuți din hexagonul său prin substituție electrofilă aromatică; un inel de pe marginile căruia se țese structura care definește compuși noi.
De fapt, derivații săi se datorează vastelor utilizări industriale pentru care au nevoie de benzen ca materie primă. De la prepararea lipiciilor și a fibrelor textile, la plastic, cauciuc, pigmenți, droguri și explozivi. Pe de altă parte, benzenul se găsește în mod natural în vulcani, incendii forestiere, benzină și fum de țigară..
Indice articol
- 1 Istorie
- 1.1 Descoperire și nume
- 1.2 Producția industrială
- 1.3 Structuri istorice
- 2 Structura benzenului
- 2.1 Rezonanță
- 2.2 Cristale
- 3 Proprietăți
- 3.1 Masa moleculară
- 3.2 Aspect fizic
- 3.3 Punctul de fierbere
- 3.4 Punctul de topire
- 3.5 Punct de aprindere
- 3.6 Temperatura de autoaprindere
- 3.7 Densitate
- 3.8 Solubilitate
- 3.9 Densitatea vaporilor
- 3.10 Presiunea vaporilor
- 3.11 Căldura de ardere
- 3.12 Căldura de vaporizare
- 3.13 tensiunea superficială
- 3.14 Indicele de refracție
- 4 Derivate
- 5 utilizări
- 6 Nomenclatură
- 7 Toxicitate
- 8 Referințe
Poveste
Descoperire și nume
Descoperirea sa datează din 1825, atribuită de obicei lui Michael Faraday, când a colectat și a făcut experimente cu un produs petrolier rămas din gazul utilizat pentru iluminat. Acest lichid conținea un raport C / H apropiat de 1, motiv pentru care el l-a numit „hidrogen carburat”.
Chimistul Auguste Laurent a numit ciudata hidrocarbură „feno”, derivată din cuvântul grecesc „phaínein„ceea ce înseamnă luminos (pentru că a fost obținut după arderea gazului). Cu toate acestea, acest nume nu a fost acceptat de comunitatea științifică și a prevalat doar ca „fenil”, pentru a se referi la radicalul derivat din benzen.
Din guma benzoină, chimistul Eilhard Mitscherlich, nouă ani mai târziu, a reușit să producă același compus; Prin urmare, a existat o altă sursă pentru aceeași hidrocarbură, pe care a botezat-o ca „benzină”. Cu toate acestea, nici ei nu au luat în considerare numele adecvat, presupunând că este vorba de un alcaloid, precum chinina..
Astfel, au înlocuit denumirea de „benzină” cu „benzol”. Cu toate acestea, din nou, au existat contradicții și discrepanțe ca urmare a termenului „benzol” care confundă hidrocarbura cu un alcool. Atunci a luat naștere numele „benzen”, folosit pentru prima dată în Franța și Anglia..
Productie industriala
Nici gazul de iluminat, nici guma de benzoină nu au fost surse adecvate pentru generarea de benzen pe scară largă. Charles Mansfield, colaborând cu August Wilhelm von Hofmann, a reușit în 1845 să izoleze benzenul (douăzeci de ani după descoperire) de gudronul de cărbune, un produs secundar al producției de cocs..
Așa a început producția industrială de benzen din gudronul de cărbune. Disponibilitatea benzenului în cantități masive a facilitat studiul proprietăților sale chimice și a permis legarea acestuia cu alți compuși cu reactivități similare. August Wilhelm von Hofmann însuși a inventat cuvântul „aromatic” pentru benzen și compuși înrudiți.
Structuri istorice
Visul lui August Kekulé
Lui Friedrich August Kekulé i se atribuie structura hexagonală și ciclică a benzenului în jurul anului 1865, izvorât dintr-un vis ciudat cu Uroboros, șarpele care își mușcă propria coadă desenând un cerc. Astfel, el credea că benzenul ar putea fi considerat un inel hexagonal, iar alți chimiști au propus structuri posibile, care sunt prezentate mai jos:

Unele dintre structurile superioare ar putea explica stabilitatea benzenului.
Carte, inele și prismă
Rețineți că a treia structură nu este nici măcar un inel, ci o prismă triunghiulară, propusă de Albert Ladenburg în 1869; în stânga lui, una în formă de carte deschisă, propusă de Sir James Dewar în 1867; iar în dreapta sa, una cu toți hidrogenii îndreptați spre centrul inelului, propusă de Henry Edward Armstrong în 1887.
Prima structură, propusă de Adolf Karl Ludwig Claus în 1867, este de asemenea destul de ciudată, deoarece legăturile C-C sunt încrucișate. Iar ultimul a fost inelul „serpentin” al lui Kekulé, visat în 1865.
Care a fost „câștigătorul”? A cincea structură (de la stânga la dreapta), propusă în 1899 de Johannes Thiele.
În acest studiu, s-a luat în considerare pentru prima dată hibridul de rezonanță, care a combinat cele două structuri Kekulé (rotiți primul inel din dreapta pentru a-l observa) și a explicat extraordinar delocalizarea electronilor și, odată cu acesta, stabilitatea până atunci neobișnuită a benzenul.
Structura benzenului
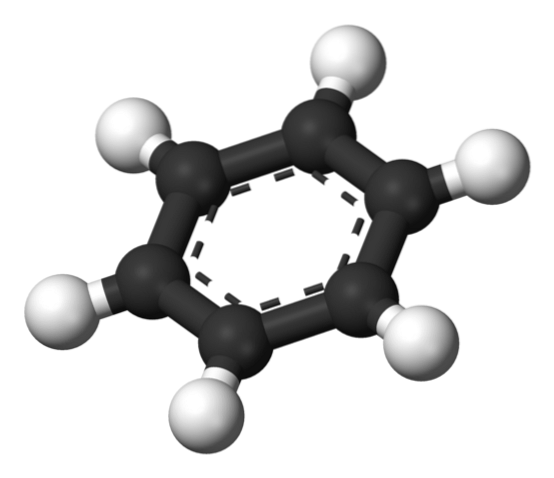
Deasupra este structura propusă de Thiele folosind un model de sfere și bare..
Molecula de benzen este plată, cu atomii de hidrogen îndreptați spre exterior din părțile laterale ale inelului. Toți atomii de carbon au hibridizare spDouă, cu un orbital p disponibil pentru stabilirea sistemului aromatic în care șase electroni se delocalizează.
Acești carboni spDouă sunt mai electronegative decât hidrogenii și, prin urmare, primele retrag densitatea electronică la celelalte (Csp2δ--Hδ+). În consecință, centrul inelului are o concentrație mai mare de electroni decât laturile sale..
Mai precis, sistemul aromatic poate fi reprezentat ca un nor electronic sau un tampon extins pe ambele părți ale inelului hexagonal; iar la mijloc, de laturi sau margini, o deficiență electronică formată din hidrogeni cu o încărcare parțială pozitivă.
Datorită acestei distribuții a sarcinilor electrice, moleculele de benzen pot interacționa între ele prin forțe dipol-dipol; H atomiδ+ sunt atrași de centrul parfumului unui inel vecin (acest lucru va fi descris mai jos).
De asemenea, centrele aromatice pot fi stivuite unul peste altul pentru a favoriza inducerea dipolilor instantanei..
Rezonanţă

Cele două structuri Kekulé sunt prezentate în partea de sus a imaginii și, sub ele, hibridul de rezonanță. Deoarece cele două structuri se repetă în același timp, hibridul este reprezentat de un cerc desenat în mijloc (similar cu cel al unei „gogoși hexagonale”).
Cercul hibrid este important deoarece indică caracterul aromatic al benzenului (și al multor alți compuși). Mai mult, el subliniază că legăturile nu sunt atât de lungi ca C-C și nici nu sunt la fel de scurte ca C = C; dar lungimea acesteia este între ambele extreme. Astfel, benzenul nu este considerat un polien.
Cele menționate anterior au fost demonstrate prin măsurarea lungimilor legăturilor C-C (139 pm) ale benzenului, care sunt puțin mai alungite decât legăturile C-H (109 pm).
Cristale
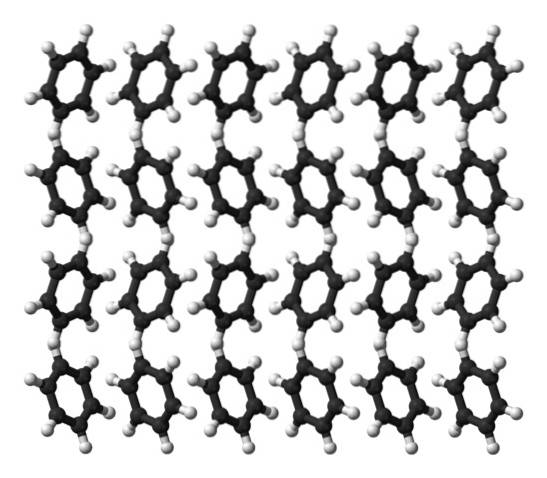
Benzenul este un lichid la temperatura camerei. Forțele sale intermoleculare înseamnă că, deși nu are un moment dipol atât de pronunțat, își poate menține moleculele împreună într-un lichid care fierbe la 80 ° C. Când temperatura scade sub 5 ° C, benzenul începe să înghețe: astfel se obțin cristale corespunzătoare..
Inelele de benzen pot adopta modele structurale definite în solidul lor. Dipolii lor îi fac să „se încline” spre stânga sau spre dreapta, formând rânduri capabile să fie reproduse de o celulă ortorombică. Astfel, cristalele de benzen sunt ortorombice.
Rețineți în imaginea superioară că înclinarea inelelor favorizează interacțiunile dintre Hδ+ și centrele aromatice, menționate în subsecțiunile anterioare.
Proprietăți
Masa moleculara
78,114 g / mol.
Aspectul fizic
Lichid incolor cu miros asemănător benzinei.
Punct de fierbere
80ºC.
Punct de topire
5.5ºC.
punctul de aprindere
-11ºC (cupă închisă).
Temperatură de autoaprindere
497,78ºC.
Densitate
0,8765 g / mL la 20 ° C.
Solubilitate
Un litru de apă clocotită abia poate dizolva 3,94 g de benzen. Caracterul său nepolar îl face practic imiscibil cu apa. Cu toate acestea, este miscibil cu alți solvenți, cum ar fi etanol, eteri, acetonă, uleiuri, cloroform, tetraclorură de carbon etc..
Densitatea vaporilor
2,8 față de aer (adică de aproape trei ori mai dens).
Presiunea de vapori
94,8 mm Hg la 25 ° C.
Căldura de ardere
-3267,6 kJ / mol (pentru benzen lichid).
Căldura de vaporizare
33,83 kJ / mol.
Tensiune de suprafata
28,22 mN / m la 25 ° C.
Indicele de refracție
1.5011 la 20 ° C.
Derivate
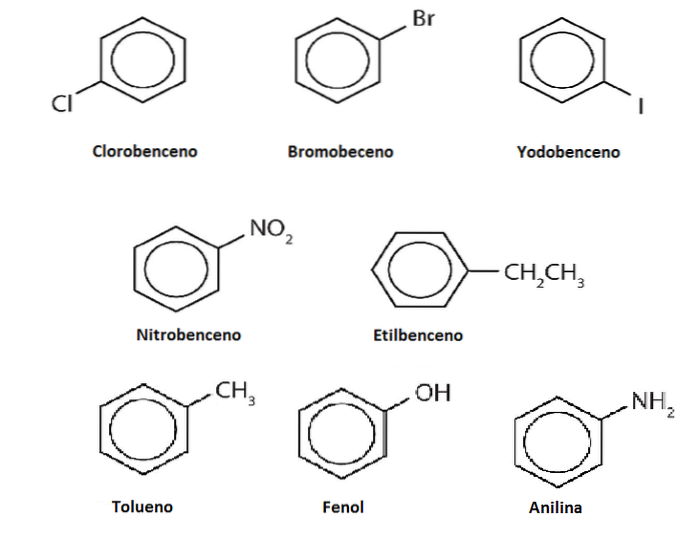
Hidrogenii benzenului pot fi înlocuiți cu alte grupuri sau atomi. Pot exista una sau mai multe substituții, crescând gradul de substituție până când nu rămâne niciunul dintre cei șase hidrogeni originali.
De exemplu, să presupunem benzenul ca Ph-H, unde H este oricare dintre cei șase hidrogeni ai săi. Amintindu-ne că centrul inelului are o densitate mai mare de electroni, acesta atrage electrofili, care atacă inelul pentru a înlocui H într-o reacție numită substituție aromatică electrofilă (SEAr).
Dacă acest H este înlocuit cu un OH, vom avea Ph-OH, fenol; fiind înlocuit de un CH3, Ph-CH3, toluen; dacă este NHDouă, Ph-NHDouă, anilină; sau dacă este CHDouăCH3, Ph-CHDouăCH3, etilbenzen.
Derivații pot fi aceiași sau mai toxici decât benzenul sau, dimpotrivă, pot deveni atât de complexi încât au un efect farmacologic de dorit..
Aplicații
Este un bun solvent pentru o mare varietate de compuși, prezenți, de exemplu, în vopsele, lacuri, adezivi și acoperiri.
De asemenea, poate dizolva uleiuri, grăsimi sau ceruri, motiv pentru care a fost folosit ca solvent de extracție pentru esențe. Această proprietate a ajuns să fie folosită de Ludwig Roselius în 1903 pentru decofeinizarea cafelei, operație care nu mai este utilizată din cauza toxicității benzenului. La fel, a fost folosit în trecut pentru degresarea metalelor.
Într-una dintre utilizările sale clasice, nu acționează ca un solvent, ci ca un aditiv: creșterea numărului octanic de benzină, înlocuind plumbul în acest scop..
Derivații benzenului pot avea utilizări diferite; unele servesc ca pesticide, lubrifianți, detergenți, materiale plastice, explozivi, parfumuri, coloranți, lipici, droguri etc. Dacă se observă un inel benzenic în structura sa, este foarte probabil ca sinteza sa să înceapă de la benzen.
Printre derivații săi cei mai importanți se numără: cumenul, xilenul, anilina, fenolul (pentru sinteza rășinilor fenolice), acidul benzoic (conservant), ciclohexanul (pentru sinteza nailonului), nitrobenzenul, resorcinolul și etilbenzenul.
Nomenclatură
Nomenclatura derivaților benzenici variază în funcție de gradul de substituție, care sunt grupele substituente și pozițiile lor relative. Astfel, benzenul poate suferi substituții mono, di, tri, tetra etc.
Când cele două grupuri sunt atașate la carboni adiacenți, se folosește denumirea „orto”; dacă există un carbon între separarea lor, „meta”; și dacă carbonii sunt în poziții opuse, „para”.
Imaginile de mai jos prezintă exemple de derivați de benzen cu denumirile respective guvernate de IUPAC. De asemenea, sunt însoțite de nume comune sau tradiționale.
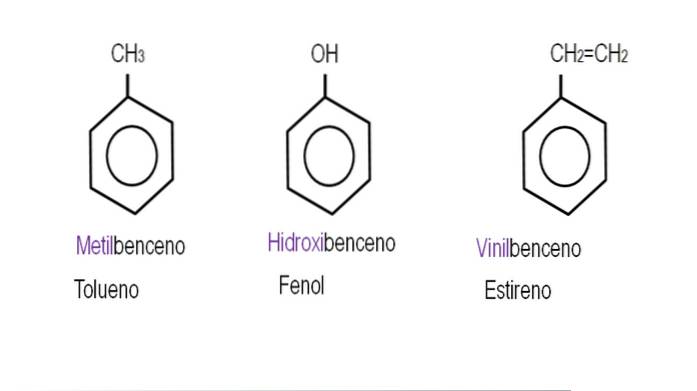
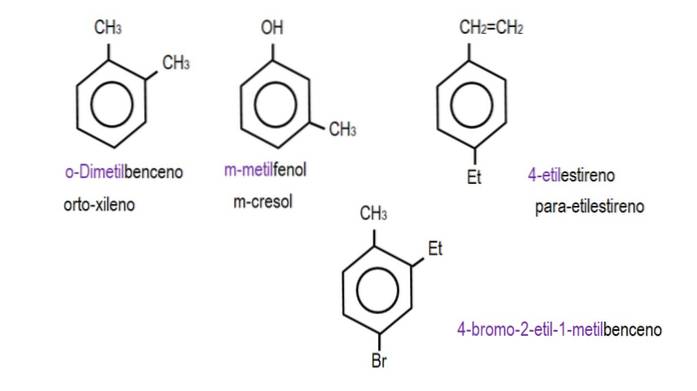
Rețineți că în benzenul trisubstituit, indicatorii orto, para și meta nu mai sunt utili..
Toxicitate
Benzenul este un compus care trebuie manipulat cu grijă. Având în vedere mirosul său special, efectele negative imediate pot fi sufocare, amețeli, dureri de cap, tremurături, somnolență, greață și chiar moarte (cu expunere mare). Dacă este ingerat, pe lângă cele menționate anterior, poate provoca dureri severe de stomac și convulsii..
În plus, efectele pe termen lung sub expunere constantă la acest lichid sunt cancerigene; crește șansele ca individul să sufere de un anumit tip de cancer, în special de sânge: leucemia.
În sânge poate reduce concentrația de celule roșii din sânge, provocând anemie și, de asemenea, afectează măduva osoasă și ficatul, unde este asimilat de organism pentru a genera derivați de benzen chiar mai toxici; de exemplu, hidroxichinonă. De asemenea, se acumulează în rinichi, inimă, plămâni și creier..
Referințe
- Morrison, R.T. și Boyd, R. N. (1987). Chimie organica. (Ediția a V-a). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Chimie organica. (Ediția a 6-a). McGraw-Hill, Interamerica, Editores S.A.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (Ediția a X-a.). Wiley plus.
- Centrul Național pentru Informații despre Biotehnologie. (2019). Benzen. Baza de date PubChem. CID = 241, recuperat de la: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Benzen. Recuperat de pe: en.wikipedia.org
- Garcia Nissa. (2019). Ce este Benzenul? - Utilizări, structură și formulă. Studiu. Recuperat de la: study.com
- Centre pentru Controlul și Prevenirea Bolilor. (04 aprilie 2018). Fapte despre benzen. Recuperat de la: emergency.cdc.gov
- Organizatia Mondiala a Sanatatii. (2010). Expunerea la benzen: o problemă majoră de sănătate publică. [PDF]. Recuperat de la: who.int
- Fernández Germán. (s.f.). Probleme de nomenclatură cu benzen. Chimie organica. Recuperat de pe: quimicaorganica.org



Nimeni nu a comentat acest articol încă.