
Formula bromurii de aluminiu, proprietăți și utilizări
bromură de aluminiu Este un compus format dintr-un atom de aluminiu și un număr variat de atomi de brom. Se formează în funcție de numărul de electroni de valență pe care îi are aluminiul.
Fiind un compus alăturat de un metal (aluminiu) și un nemetal (brom), se formează legături covalente care conferă structurilor o stabilitate foarte bună, dar fără a ajunge la cea a unei legături ionice..
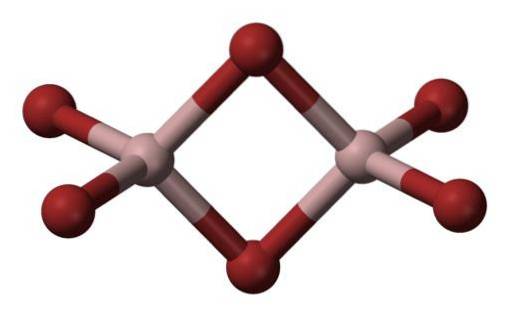
Bromura de aluminiu este o substanță care apare în mod normal în stare solidă, cu o structură cristalină.
Culorile diferitelor bromuri de aluminiu apar ca galbeni palizi de nuanțe diferite și, uneori, apar fără culoare aparentă.
Culoarea depinde de capacitatea de reflexie a luminii a compusului și se schimbă în funcție de structurile create și de formele pe care le ia..
Starea solidă a acestor compuși cristalizează, deci au structuri bine definite, cu aspect similar sării de mare, dar de culoare variabilă..
Formulă
Bromura de aluminiu este alcătuită dintr-un atom de aluminiu (Al) și cantități diferite de atomi de brom (Br), în funcție de electronii de valență pe care îi are aluminiul..
Din acest motiv, formula generală pentru bromura de aluminiu poate fi scrisă după cum urmează: AlBrx, unde "x" este numărul de atomi de brom care se leagă de aluminiu.
Cea mai comună formă în care apare este ca Al2Br6, care este o moleculă cu doi atomi de aluminiu ca bază principală a structurii..
Legăturile dintre ele sunt formate din doi bromi în mijloc, astfel încât fiecare atom de aluminiu are patru atomi de brom în structura sa, dar la rândul lor, aceștia împart doi.
Proprietăți
Datorită naturii sale, este foarte solubil în apă, dar este parțial solubil în compuși precum metanolul și acetona, spre deosebire de alte tipuri de substanțe..
Are o greutate moleculară de 267 g / mol și este format din legături covalente.
Bromura de sodiu atinge punctul de fierbere la 255 ° C și atinge punctul de topire la 97,5 ° C.
O altă caracteristică a acestui compus este că emite toxine atunci când se evaporă, deci nu este recomandat să lucrați cu el la temperaturi ridicate fără protecție adecvată și cunoștințe relevante de siguranță..
Aplicații
Una dintre utilizările date acestui tip de substanță datorită naturii sale metalice și nemetalice este cea a agenților în testele de puritate chimică..
Testarea purității este foarte importantă pentru a determina calitatea reactivilor și pentru a produce produse cu care oamenii sunt mulțumiți..
În cercetarea științifică este utilizat într-un mod foarte variabil. De exemplu, pentru a forma structuri complexe, agenți în sinteza altor produse chimice valoroase, în hidrogenarea dihidroxinaftalenelor și în selectivitatea în reacții, printre alte utilizări..
Acest compus nu este popular din punct de vedere comercial. După cum sa văzut mai sus, are câteva aplicații care sunt foarte specifice, dar foarte interesante pentru comunitatea științifică..
Referințe
- Chang, R. (2010). Chimie (ed. A X-a) McGraw-Hill Interamericana.
- Krahl, T. și Kemnitz, E. (2004). Fluorură de bromură de aluminiu amorfă (ABF). Angewandte Chemie - Ediție internațională, 43(48), 6653-6656. doi: 10.1002 / anie.200460491
- Golounin, A., Sokolenko, V., Tovbis, M. și Zakharova, O. (2007). Complexe de nitronaftoli cu bromură de aluminiu. Revista Rusă de Chimie Aplicată, 80(6), 1015-1017. doi: 10.1134 / S107042720706033X
- Koltunov, K. Y. (2008). Condensarea naftalenediolilor cu benzen în prezența bromurii de aluminiu: o sinteză eficientă a 5-, 6- și 7-hidroxi-4-fenil-1- și 2-tetralone. Litere de tetraedru, 49(24), 3891-3894. doi: 10.1016 / j.tetlet.2008.04.062
- Guo, L., Gao, H., Mayer, P. și Knochel, P. (2010). Prepararea reactivilor organoaluminici din bromuri propargilice și aluminiu activat de PbCl2 și adăugarea lor regio- și diastereoselectivă la derivații carbonilici. Chemistry-a European Journal, 16(32), 9829-9834. doi: 10.1002 / chem.201000523
- Ostashevskaya, L. A., Koltunov, K. Y. și Repinskaya, I. B. (2000). Hidrogenarea ionică a dihidroxinaftalenelor cu ciclohexan în prezența bromurii de aluminiu. Revista Rusă de Chimie Organică, 36(10), 1474-1477.
- Iijima, T. și Yamaguchi, T. (2008). Carboxilare regioselectivă eficientă a fenolului în acid salicilic cu CO2 supercritic în prezența bromurii de aluminiu. Journal of Molecular Catalysis A: Chemical, 295(1-2), 52-56. doi: 10.1016 / j.molcata.2008.07.017
- Murachev, V. B., Byrikhin, V. S., Nesmelov, A. I., Ezhova, E. A. și Orlinkov, A. V. (1998). Studiu spectroscopic 1H RMN al sistemului de inițiere cationică a clorurii de terț-butil - bromură de aluminiu. Buletin chimic rus, 47(11), 2149-2154.
Nimeni nu a comentat acest articol încă.