
Structura analitică, proprietăți, utilizări și riscuri
butanal este o aldehidă cu lanț deschis, formată din patru atomi de carbon și este analogă butanului; este de fapt a doua formă cea mai oxidată a hidrocarburii butan după acidul butiric. Formula sa moleculară este CH3CHDouăCHDouăCHO, unde -CHO este gruparea formil.
Această aldehidă, una dintre cele mai ușoare, constă dintr-un lichid transparent, inflamabil, care este mai puțin dens decât apa. În plus, este solubil în apă și miscibil cu majoritatea solvenților organici; de aceea poate fi folosit pentru a avea amestecuri organice monofazate.
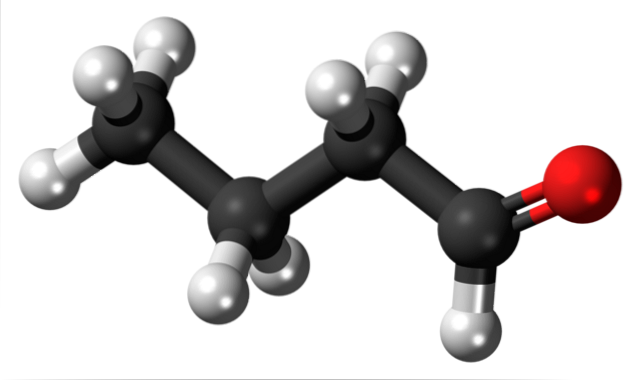
Prezența grupării carbonil (cea a sferei roșii, imaginea superioară) conferă polaritate chimică moleculei butanale și, prin urmare, capacitatea de a experimenta interacțiunea dipol-dipol între moleculele sale; deși nu se formează legături de hidrogen între ele.
Acest lucru are ca rezultat butanalul având puncte de fierbere și topire mai mari decât butanul, dar mai mici decât cele prezentate de alcoolul n-butilic..
Butanalul este utilizat ca solvent și este un intermediar pentru a obține numeroase produse; cum ar fi acceleratorii de vulcanizare pentru cauciucuri, rășini, produse farmaceutice și agrochimice.
Butanalul este un compus toxic care, prin inhalare, poate provoca inflamații ale căilor respiratorii superioare, bronhiilor și edem pulmonar, care poate avea chiar consecințe fatale.
Indice articol
- 1 Structura butanalului
- 1.1 Conformatori
- 2 Proprietăți
- 2.1 Denumiri chimice
- 2.2 Formula moleculară
- 2.3 Aspect fizic
- 2.4 Miros
- 2.5 Punctul de fierbere
- 2.6 Punct de topire
- 2.7 Punct de aprindere
- 2.8 Solubilitatea în apă
- 2.9 Solubilitate în solvenți organici
- 2.10 Densitate
- 2.11 Densitatea vaporilor
- 2.12 Presiunea vaporilor
- 2.13 Autoaprindere
- 2.14 Vâscozitatea
- 2.15 Căldura de ardere
- 2.16 Căldura de vaporizare
- 2.17 Tensiunea superficială
- 2.18 Pragul mirosului
- 2.19 Indicele de refracție
- 2.20 Momentul dipol
- 2.21 Lungimile de undă (λ) de absorbție maximă în apă
- 2.22 Polimerizare
- 2.23 Reactivitate
- 2.24 Condensare aldolică
- 3 Sinteza
- 4 utilizări
- 4.1 Industrial
- 4.2 Altele
- 5 Riscuri
- 6 Referințe
Structura butanală
Tocmai s-a menționat că gruparea formil, -CHO, conferă polaritate moleculei butanal sau butiraldehidă datorită electronegativității mai mari a atomului de oxigen. Ca urmare, moleculele sale pot interacționa între ele prin forțe dipol-dipol..
În imaginea superioară se arată, cu un model de sfere și bare, că molecula butanală are o structură liniară. Carbonul grupului -CHO are hibridizare spDouă, în timp ce carbonii rămași sp hibridizează3.
Nu numai asta, dar este și flexibil, iar legăturile sale se pot roti pe propriile axe; și astfel, sunt generate diferite conformații sau conformeri (același compus, dar cu legăturile lor rotite).
Conformatori
Următoarea imagine explică mai bine acest punct:
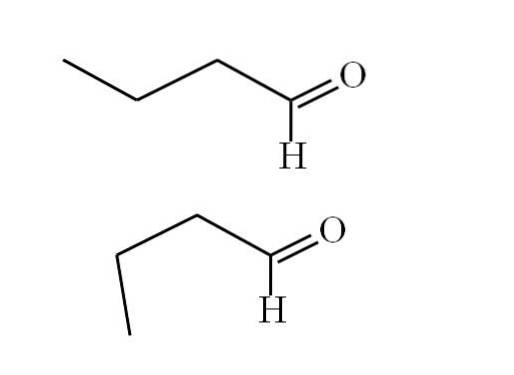
Primul conformer (cel superior) corespunde moleculei din prima imagine: grupul metil din stânga, -CH3, și grupul -CHO, sunt în poziții anti paralele între ele; unul arată în sus, iar celălalt în jos, respectiv.
Între timp, al doilea conformer (cel inferior) corespunde moleculei cu -CH3 și -CHO în poziții eclipsate; adică amândoi indică în aceeași direcție.
Ambii conformatori sunt rapid interschimbabili și, prin urmare, molecula butanală se rotește și vibrează constant; și a adăugat faptul că are un dipol permanent, acest lucru permite interacțiunilor sale să fie suficient de puternice pentru a fierbe la 74,8 ° C..
Proprietăți
Denumiri chimice
-Butanal
-Butiraldehidă
-1-Butanal
-Butiral
-N-butiraldehidă.
Formulă moleculară
C4H8O sau CH3CHDouăCHDouăCHO.
Aspectul fizic
Este un lichid transparent, transparent.
Miros
Miros caracteristic, înțepător, aldehidic.
Punct de fierbere
167ºF la 760mmHg (74,8ºC).
Punct de topire
-146 ºF (-96,86 ºC).
punctul de aprindere
-8ºF (-22ºC) cupă închisă.
Solubilitatea apei
7 g / 100 ml la 25 ° C.
Solubilitate în solvenți organici
Miscibil cu etanol, eter, acetat de etil, acetonă, toluen și mulți alți solvenți organici.
Densitate
0,803 g / cm3 la 68ºF.
Densitatea vaporilor
2,5 (în raport cu aerul luat egal cu 1).
Presiunea de vapori
111 mmHg la 25 ° C.
Autoaprindere
446ºF. 425ºF (21.8ºC).
Viscozitate
0,45 cPoise la 20 ° C.
Căldura de ardere
2479,34 kJ / mol la 25 ° C.
Căldura de vaporizare
33,68 kJ / mol la 25 ° C.
Tensiune de suprafata
29,9 dyna / cm la 24 ° C.
Pragul mirosului
0,009 ppm.
Indicele de refracție
1,3843 la 20 ° C.
Momentul dipol
2,72 D.
Lungimile de undă (λ) de absorbție maximă în apă
225 nm și 282 nm (lumină ultravioletă).
Polimerizare
Butanalul se poate polimeriza în contact cu alcalii sau acidul, polimerizarea fiind periculoasă.
Reactivitate
Când este expus aerului, se oxidează, formând acid butiric. La o temperatură de 230 ° C, butanalul se aprinde spontan cu aerul.
Condensarea aldolului
Două molecule de butanal pot reacționa între ele, în prezența KOH și o temperatură de 6-8 ° C, pentru a forma compusul 2-etil-3-hidroxihexanol. Acest tip de compus se numește aldol, deoarece are în structura sa o grupare aldehidă și o grupare alcoolică.
Sinteză
Butanalul poate fi produs prin deshidrogenarea catalitică a alcoolului n-butilic; hidrogenarea catalitică a crotonaldehidei; și hidroformilarea propilenei.
Aplicații
Industrial
-Butanalul este un solvent industrial, dar este și un intermediar în sinteza altor solvenți; de exemplu 2-etilhexanol, n-butanol și trimetilpropan.
-Este, de asemenea, utilizat ca intermediar în producția de rășini sintetice, inclusiv polivinil butiral; acceleratori de vulcanizare cauciuc; fabricarea produselor farmaceutice; produse de protecție a culturilor; pesticide; antioxidanți; ajutoare pentru bronzare.
-Butanalul este utilizat ca materie primă pentru producerea de arome sintetice. În plus, este utilizat ca agent aromatizant alimentar.
Alții
-La om, butanalul este utilizat ca biomarker indicativ al deteriorării oxidative a lipidelor, proteinelor și acizilor nucleici.
-A fost folosit experimental, împreună cu formalină și glutardehidă, pentru a încerca să reducă înmuierea experimentată de copitele vitelor, datorită expunerii la apă, urină și fecale ale bovinelor. Rezultatele experimentale au fost pozitive.
Riscuri
Butanalul este distructiv pentru membranele mucoasei tractului respirator superior, precum și pentru țesuturile pielii și ale ochilor..
Prin contactul cu pielea provoacă roșeață și arsuri. În ochi, apar aceleași leziuni, însoțite de durere și leziuni ale țesutului ocular.
Inhalarea butanalului poate avea consecințe grave, deoarece poate provoca inflamații și edeme la nivelul laringelui și bronhiilor; în timp ce în plămâni, produce pneumonie chimică și edem pulmonar.
Semnele supraexpunerii includ: senzații de arsură la nivelul căilor respiratorii superioare, tuse, respirație șuierătoare, adică respirație șuierătoare la respirație; laringită, dificultăți de respirație, cefalee, greață și vărsături.
Inhalarea poate fi fatală ca urmare a spasmului căilor respiratorii.
Ingerarea butanalului provoacă o senzație de „arsură” în tractul digestiv: cavitate bucală, faringe, esofag și stomac.
Referințe
- Morrison, R. T. și Boyd, R. N. (1987). Chimie organica. (5ta Ediție.). Editorial Addison-Wesley Iberoamericana.
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- PubChem. (2019). Butanal. Recuperat de la: pubchem.ncbi.nim.nih.guv
- Wikipedia. (2019). Butanal. Recuperat de pe: es.wikipedia.org
- Carte chimică. (2017). Butanal. Recuperat de pe: chemicalbook.com
- Basf. (Mai 2017). N-butiraldehidă. [PDF]. Recuperat de pe: solvents.basf.com



Nimeni nu a comentat acest articol încă.