
Căldură latentă

Ce este căldura latentă?
Căldura latentă este cantitatea de căldură pe care o substanță trebuie să o absoarbă sau să o elibereze pentru a-și schimba starea fizică sau faza, menținând temperatura constantă în timpul acestui proces. Căldura furnizată sau eliberată nu se manifestă, nu se „simte” ca de obicei în variația temperaturii; de aici si termenul de caldura latenta.
Cuvântul latent provine din cuvântul latin „latens” care înseamnă ascuns, astfel că căldura latentă se comportă de parcă nu ar exista atunci când temperatura a fost menținută constantă. Dar există: ceea ce se întâmplă este că este consumat în totalitate în schimbarea fazei sau în starea fizică.
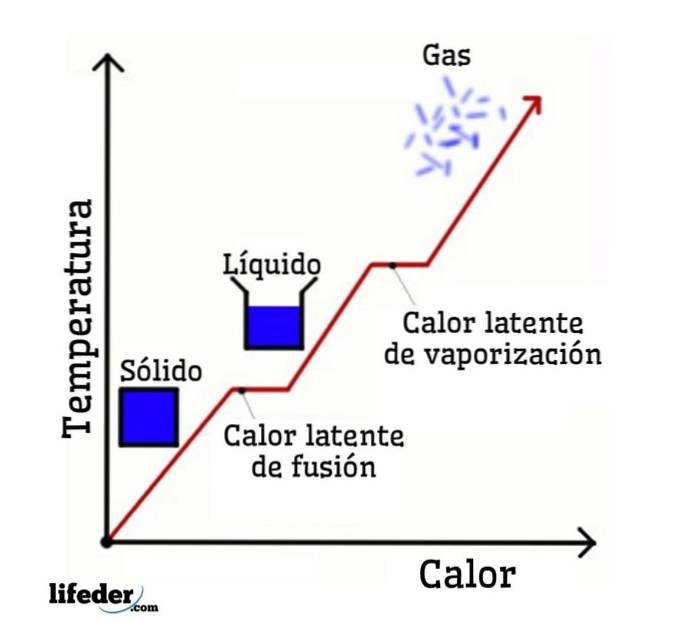
Luând ca exemplu apa, schimbările de fază sunt după cum urmează: gheața (solidă) se topește în apă lichidă (lichidă) într-un proces numit topire; iar apa lichidă la rândul ei vaporizează pentru a se transforma în vapori de apă (gaz) într-un proces numit vaporizare.
Pe de altă parte, vaporii de apă sunt răciti în apă lichidă într-un proces numit condens; iar apa lichidă se transformă înapoi în gheață într-un proces numit solidificare.
Fiecare dintre aceste modificări de fază este asociată cu o căldură latentă, care poate fi pozitivă (absorbție) sau negativă (eliberare)..
Căldura latentă de fuziune

Este cantitatea de căldură care trebuie furnizată unei cantități date de substanță solidă pentru a-și schimba starea fizică din solid în lichid. În timpul fuziunii nu există schimbări de temperatură, așa că, în timp ce solidul se topește sau se topește, lichidul generat din acesta are aceeași temperatură ca întregul solid.
În general, această căldură este determinată la punctul normal de topire, care este temperatura la care solidul începe să se topească sub presiunea atmosferică. La această temperatură există un echilibru sau o prezență simultană a stării solide și a stării lichide în același timp..
Starea solidă se caracterizează prin prezența unei structuri compacte datorită existenței unor legături chimice de mare energie, care îi conferă rigiditate structurală. Pentru transformarea unui solid în lichid, aceste interacțiuni trebuie rupte, astfel încât energia este consumată (absorbită) în acest scop.
Un exemplu tipic este atunci când se consumă o înghețată, formată din apă, zahăr și alte substanțe. Este obișnuit să observăm că înghețata, dacă nu este consumată rapid, începe să se topească, adică să se topească. Acest lucru se întâmplă atunci când temperatura înghețatei atinge punctul de topire al gheții..
Exemple
Vor fi enumerate câteva exemple de călduri latente de fuziune exprimate în J / g; adică energia pe care un gram de solid trebuie să o absoarbă pentru a se topi la punctul de topire:
-Gheață 334.0
-Aluminiu 380.0
-Sulf 38.1
-Cupru 134.0
-Etanol 104,0
-Mercur 11.8
-Aur 64,5
-Argint 80.3
-Plumb 24.5
-184
Gheața absoarbe multă căldură nu pentru că interacțiunile sale sunt mai puternice, ci pentru că este capabilă să disipeze în mod excepțional căldura între cristalele sale..
Căldură latentă de vaporizare
Este cantitatea de căldură pe care o cantitate dată de substanță o absoarbe pentru a trece de la o stare lichidă la o stare gazoasă la punctul de fierbere normal. Adică este căldura pe care lichidul o absoarbe atunci când fierbe și se transformă în gaz fără o creștere a temperaturii..
În lichid, moleculele substanțelor pot interacționa prin formarea de legături de hidrogen și prin forțe de atracție între molecule. Pentru a trece o substanță din starea lichidă în starea gazoasă, aceste forțe trebuie depășite, deci trebuie furnizată căldură.
Căldura sensibilă este ceea ce lichidul absoarbe doar pentru a-și crește temperatura, care va depinde de căldura sa specifică. Între timp, căldura latentă de vaporizare este utilizată pentru a o transforma direct în abur, proces care este mult mai ușor la punctul de fierbere..
Exemple
Mai jos sunt enumerate exemple ale unor lichide cu căldurile lor latente respective de vaporizare exprimate din nou în J / g:
-Acid acetic 402
-Acetonă 518
-Apa 2256
-Alcool etilic 846
-Sulf 1510
-390. Benzen
-Dioxid de carbon 574
-Clor 293
-Eter 377
-Glicerina 974
-295. Mercur
-Oxigenul 214
Rețineți căldura latentă enormă a apei lichide: 1 g de apă lichidă (aproximativ 1 ml) trebuie să absoarbă 2256 J pentru a se vaporiza. Apa lichidă disipă căldura pe care o primește și mai bine în comparație cu gheața.
Căldură latentă de solidificare
Este căldura pe care o anumită cantitate de substanță trebuie să o degajeze pentru a trece de la starea sa lichidă la starea sa solidă la punctul de solidificare sau îngheț. Din nou, până când lichidul s-a solidificat complet, temperatura va rămâne constantă..
Procesul de solidificare este inversul procesului de fuziune, deci valorile căldurii latente de solidificare și cele ale căldurii latente de fuziune sunt aceleași, dar cu semne opuse..
Moleculele unei substanțe în stare lichidă se mișcă cu o anumită libertate datorită energiei pe care o posedă. Prin urmare, pentru a trece la faza solidă, moleculele trebuie să elibereze energie sub formă de căldură, ceea ce permite o interacțiune mai mare între moleculele substanței..
Interacțiunea dintre molecule favorizează formarea legăturilor chimice ale fazei solide. Un exemplu în acest sens apare atunci când apa lichidă este plasată în recipientele care formează gheață în congelatorul frigorific. Congelatorul extrage căldura din apa lichidă și se solidifică pentru a deveni gheață.
Exemple
Câteva exemple de călduri latente de solidificare (în J / g) pentru unele lichide sunt enumerate mai jos:
-Apă (-334)
-Aluminiu (-380)
-Sulf (-38)
-Cupru (-134)
-Etanol (-104)
Căldură latentă de condens
Este cantitatea de căldură care trebuie degajată sau eliberată dintr-o anumită cantitate de substanță, pentru a trece de la starea gazoasă la starea lichidă. Gazul care se condensează și lichidul format mențin aceeași temperatură în timpul condensării.
Condensarea este opusul vaporizării. Căldura latentă de condens are aceeași valoare ca și căldura latentă de vaporizare, dar cu semnul opus și la punctul de fierbere. Un exemplu în acest sens este când gătitul și aburul se condensează în interiorul oalelor..
Moleculele gazoase se mișcă liber conduse de energia pe care o posedă. Prin urmare, trebuie să elibereze energie pentru a permite interacțiunilor intermoleculare ale stării lichide să se stabilească între moleculele substanței..
În natură există multe alte exemple ale fenomenului de condensare a apei. Vaporii de apă cresc în atmosferă și se condensează în nori sub formă de picături de apă.
Se observă și prezența picăturilor de apă în geamurile mașinii, ca urmare a condensării apei datorată unei scăderi a temperaturii care are loc dimineața devreme, constituind așa-numita rouă.
Exemple
În cele din urmă, pentru unii vapori vor fi enumerate căldurile lor latente de condensare exprimate, încă o dată, în J / g:
-Acid acetic (-402)
-Acetonă (-518)
-Apă (-2256)
-Alcool etilic (-846)
-Sulf (-1510)
-Benzen (-390)
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Walter J. Moore. (1963). Chimie Fizica. În cinetica chimică. Ediția a patra, Longmans.
- Wikipedia. (2020). Căldură latentă. Recuperat de pe: en.wikipedia.org
- Editorii Enciclopediei Britanice. (2020). Căldură latentă. Recuperat de pe: britannica.com
- Inginerie ToolBox. (2003). Fluide: căldură latentă de evaporare. Recuperat de pe: engineeringtoolbox.com
- Lumen Learning. (s.f.). Schimbare de fază și căldură latentă. Recuperat de la: courses.lumenlearning.com


Nimeni nu a comentat acest articol încă.