
Calorimetrie ce studii și aplicații
calorimetrie este o tehnică care determină modificările conținutului caloric al unui sistem asociat cu un proces chimic sau fizic. Se bazează pe măsurarea schimbărilor de temperatură atunci când un sistem absoarbe sau emite căldură. Calorimetrul este echipamentul utilizat în reacțiile în care este implicat un schimb de căldură.
Ceea ce este cunoscut sub numele de „ceașcă de cafea” este cea mai simplă formă a acestui tip de aparat. Prin utilizarea sa, se măsoară cantitatea de căldură implicată în reacțiile efectuate la presiune constantă într-o soluție apoasă. Un calorimetru pentru ceașcă de cafea constă dintr-un recipient din polistiren, care este plasat într-un pahar..

Apa este plasată în recipientul din polistiren, prevăzut cu un capac din același material care îi conferă un anumit grad de izolare termică. În plus, recipientul are un termometru și un agitator mecanic..
Acest calorimetru măsoară cantitatea de căldură care este absorbită sau emisă, în funcție de reacția endotermă sau exotermă, când are loc o reacție într-o soluție apoasă. Sistemul care urmează să fie studiat este alcătuit din reactanți și produse.
Indice articol
- 1 Ce studiază calorimetria?
- 2 Capacitatea termică a unui calorimetru
- 2.1 Exemplu de utilizare a calorimetrului pentru a calcula căldura specifică
- 3 Pompa calorimetrică
- 4 Tipuri de calorimetru
- 4.1 Calorimetru de titrare izotermă (CTI)
- 4.2 Calorimetru de scanare diferențială
- 5 Aplicații
- 5.1 Utilizări ale calorimetriei de titrare izotermă
- 5.2 Utilizări ale calorimetriei de scanare diferențială
- 6 Referințe
Ce studiază calorimetria?
Calorimetria studiază relația dintre energia termică asociată unei reacții chimice și modul în care este utilizată pentru a determina variabilele sale. Aplicațiile lor în domeniile de cercetare justifică scopul acestor metode.
Capacitatea calorică a unui calorimetru
Această capacitate se calculează împărțind cantitatea de căldură absorbită de calorimetru la modificarea temperaturii. Această variație este produsul căldurii emise într-o reacție exotermă, care este egală cu:
Cantitatea de căldură absorbită de calorimetru + cantitatea de căldură absorbită de soluție
Variația poate fi determinată prin adăugarea unei cantități cunoscute de căldură prin măsurarea modificării temperaturii. Pentru această determinare a capacității calorice, se folosește de obicei acid benzoic, deoarece este cunoscută căldura sa de ardere (3.227 kJ / mol).
Capacitatea calorică poate fi determinată și prin adăugarea de căldură prin intermediul unui curent electric.
Exemplu de a utiliza calorimetrul pentru a calcula căldura specifică
O bară de 95 g a unui metal este încălzită la 400 ° C, ducându-l imediat la un calorimetru cu 500 g de apă, inițial la 20 ° C. Temperatura finală a sistemului este de 24 ° C. Calculați căldura specifică a metalului.
Δq = m x ce x Δt
În această expresie:
Δq = variația sarcinii.
m = masa.
ce = căldură specifică.
Δt = variația temperaturii.
Căldura acumulată de apă este egală cu căldura degajată din bara de metal.
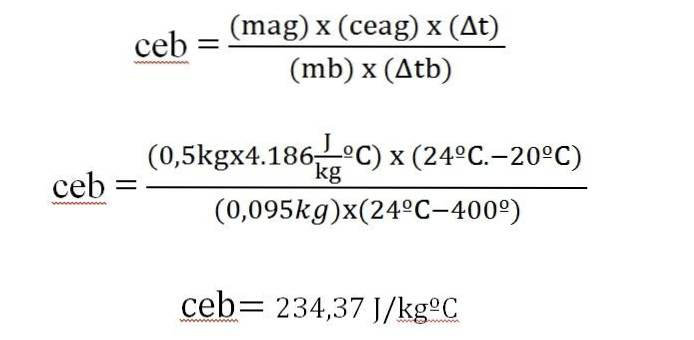
Această valoare este similară cu cea care apare într-un tabel al căldurii specifice pentru argint (234 J / kg ºC).
Deci, una dintre aplicațiile calorimetriei este cooperarea pentru identificarea materialelor.
Pompa calorimetrica
Se compune dintr-un recipient din oțel, cunoscut sub numele de pompă, rezistent la presiunile ridicate care pot apărea în timpul reacțiilor care apar în acest container; acest container este conectat la un circuit de aprindere pentru a porni reacțiile.
Pompa este scufundată într-un recipient mare cu apă, a cărui funcție este de a absorbi căldura generată în pompă în timpul reacțiilor, făcând variația de temperatură mică. Recipientul de apă este echipat cu un termometru și un agitator mecanic.
Schimbările de energie sunt măsurate la un volum și la o temperatură practic constante, astfel încât nu se lucrează la reacțiile care apar în pompă.
ΔE = q
ΔE este variația energiei interne din reacție și q căldura generată în aceasta.
Tipuri de calorimetru
Calorimetru de titrare izotermă (CTI)
Calorimetrul are două celule: într-una se plasează proba și în cealaltă, referință, în general se plasează apă.
Diferența de temperatură generată între celule - datorită reacției care are loc în celula eșantion - este anulată de un sistem de feedback care injectează căldură pentru a egaliza temperaturile celulelor..
Acest tip de calorimetru permite urmărirea interacțiunii dintre macromolecule și liganzii acestora..
Calorimetru de scanare diferențială
Acest calorimetru are două celule, precum CTI, dar are un dispozitiv care permite determinarea fluxurilor de temperatură și căldură asociate cu modificările unui material în funcție de timp.
Această tehnică oferă informații despre plierea proteinelor și acizilor nucleici, precum și stabilizarea acestora..
Aplicații

-Calorimetria permite determinarea schimbului de căldură care are loc într-o reacție chimică, permițând astfel o înțelegere mai clară a mecanismului acesteia.
-Prin determinarea căldurii specifice a unui material, calorimetria oferă date care ajută la identificarea acestuia.
-Deoarece există o proporționalitate directă între schimbarea de căldură a unei reacții și concentrația reactanților, împreună cu faptul că calorimetria nu necesită probe clare, această tehnică poate fi utilizată pentru a determina concentrația substanțelor prezente în matricile complexe..
-În domeniul ingineriei chimice, calorimetria este utilizată în procesul de siguranță, precum și în diferite domenii ale procesului de optimizare, reacție chimică și în unitatea de funcționare..
Utilizări ale calorimetriei de titrare izotermă
-Colaborează la stabilirea mecanismului de acțiune enzimatică, precum și la cinetica sa. Această tehnică poate măsura reacțiile dintre molecule, determinând afinitatea de legare, stoichiometria, entalpia și entropia în soluție fără a fi nevoie de markeri..
-Evaluează interacțiunea nanoparticulelor cu proteinele și, împreună cu alte metode analitice, este un instrument important pentru înregistrarea modificărilor conformaționale ale proteinelor.
-Are aplicare în conservarea alimentelor și a culturilor.
-În ceea ce privește conservarea alimentelor, puteți determina deteriorarea și termenul de valabilitate (activitate microbiologică). Poate compara eficiența diferitelor metode de conservare a alimentelor și poate determina doza optimă de conservanți, precum și degradarea în controlul ambalajului.
-În ceea ce privește culturile de legume, puteți studia germinarea semințelor. Fiind în apă și în prezența oxigenului, eliberează căldură care poate fi măsurată cu un calorimetru izoterm. Examinați vârsta și depozitarea necorespunzătoare a semințelor și studiați rata de creștere a acestora în fața variațiilor de temperatură, pH sau diferite substanțe chimice.
-În cele din urmă, puteți măsura activitatea biologică a solurilor. În plus, poate detecta boli.
Utilizări ale calorimetriei de scanare diferențială
-Împreună cu calorimetria izotermă, a făcut posibilă studierea interacțiunii proteinelor cu liganzii lor, interacțiunea alosterică, plierea proteinelor și mecanismul de stabilizare a acestora..
-Căldura care este eliberată sau absorbită în timpul unui eveniment de legătură moleculară poate fi măsurată direct.
-Calorimetria cu scanare diferențială este un instrument termodinamic pentru stabilirea directă a absorbției de energie termică care are loc într-o probă. Acest lucru face posibilă analiza factorilor implicați în stabilitatea moleculei de proteină..
-El studiază, de asemenea, termodinamica tranziției de pliere a acidului nucleic. Tehnica permite determinarea stabilității oxidative a acidului linoleic izolat și cuplat cu alte lipide.
-Tehnica este aplicată în cuantificarea nanosolidelor pentru uz farmaceutic și în caracterizarea termică a transportorilor de lipide nanostructurate..
Referințe
- Whitten, K., Davis, R., Peck, M. și Stanley, G. Chimie. (2008). A 8-a ed. Cengage Learning Edit.
- Rehak, N. N. și Young, D. S. (1978). Aplicații prospective de calorimetrie în laboratorul clinic. Clin. Chem.24 (8): 1414-1419.
- Stossel, F. (1997). Aplicații ale calorimetriei de reacție în ingineria chimică. J. Therm. Anal. 49 (3): 1677-1688.
- Weber, P. C. și Salemme, F. R. (2003). Aplicații ale metodelor calorimetrice la descoperirea medicamentelor și studiul interacțiunilor proteice. Curr. Opin. Struct. Biol. 13 (1): 115-121.
- Gill, P., Moghadem, T. și Ranjbar, B. (2010). Tehnici calorimetrice de scanare diferențială: aplicații în biologie și nanoștiință. J. Biol. Teh. 21 (4): 167-193.
- Omanovic-Miklicanin, E., Manfield, I. și Wilkins, T. (2017). Aplicațiile calorimetriei de titrare izotermă în evaluarea interacțiunilor proteină-nanoparticule. J. Therm. Anal. 127: 605-613.
- Community College Consortium for Bioscience Credentials. (7 iulie 2014). Calorimetru ceașcă de cafea. [Figura]. Adus pe 7 iunie 2018, de pe: commons.wikimedia.org



Nimeni nu a comentat acest articol încă.