
Modificări ale tipurilor de stare și ale caracteristicilor acestora (cu exemple)

modificări de stare sau faza sunt un fenomen termodinamic în care materia suferă modificări fizice reversibile. Se spune că este termodinamic deoarece se produce un transfer de căldură între materie și împrejurimi; sau ceea ce este același, există interacțiuni între materie și energie care induc o rearanjare a particulelor.
Particulele care suferă schimbarea stării rămân aceleași înainte și după schimbare. Presiunea și temperatura sunt variabile importante în modul în care sunt adaptate într-o fază sau alta. Când are loc o schimbare de stare, se formează un sistem bifazic, alcătuit din aceeași materie în două stări fizice diferite.
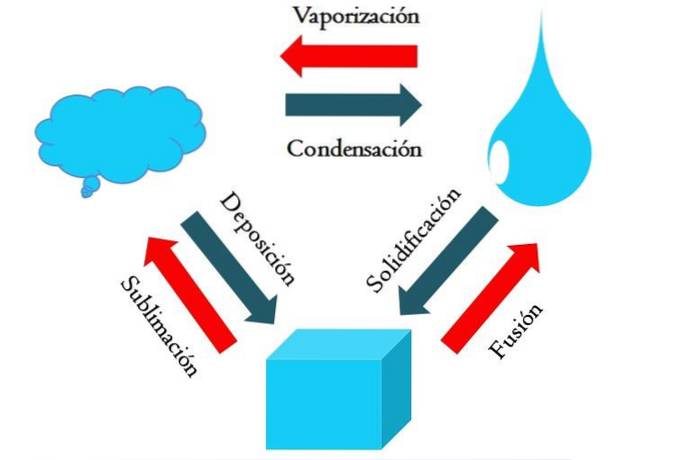
Imaginea de mai sus prezintă principalele modificări de stare pe care le suferă materia în condiții normale..
Un cub solid dintr-o substanță albăstruie poate deveni lichid sau gazos în funcție de temperatura și presiunea din jur. În sine reprezintă o singură fază: solidul. Dar, în momentul topirii, adică a topirii, se stabilește un echilibru solid-lichid numit fuziune (săgeată roșie între cubul albastru și picătură).
Pentru a se produce fuziunea, cubul trebuie să absoarbă căldura din împrejurimile sale pentru a-și crește temperatura; prin urmare, este un proces endoterm. Odată ce cubul este complet topit, acesta revine la o singură fază: cea a stării lichide.
Această picătură albăstruie poate continua să absoarbă căldura, ceea ce îi mărește temperatura și are ca rezultat formarea de bule gazoase. Din nou, există două faze: una lichidă și cealaltă gaz. Când tot lichidul s-a evaporat prin punctul său de fierbere, se spune că a fiert sau s-a vaporizat..
Acum picăturile albăstrui s-au transformat în nori. Până în prezent, toate procesele au fost endoterme. Gazul albastru poate continua să absoarbă căldura până devine fierbinte; Cu toate acestea, având în vedere condițiile terestre, tinde să se răcească și să se condenseze înapoi în lichid (condensare)..
Pe de altă parte, norii pot fi depuși direct pe o fază solidă, formând din nou cubul solid (depunere). Aceste ultime două procese sunt exoterme (săgeți albastre); adică eliberează căldură mediului sau împrejurimilor.
În plus față de condens și depunere, o schimbare de stare are loc atunci când picătura albăstruie îngheață la temperaturi scăzute (solidificare).
Indice articol
- 1 Tipuri de modificări de stare și caracteristicile acestora
- 1.1 - Fuziune
- 1.2 - Vaporizare
- 1.3 - Condensare
- 1.4 - Solidificare
- 1.5 - Sublimarea
- 1.6 - Depunere
- 2 Alte modificări de stare
- 3 Referințe
Tipuri de schimbări de stare și caracteristicile acestora
Imaginea prezintă modificări tipice pentru cele trei (cele mai frecvente) stări ale materiei: solid, lichid și gaz. Modificările însoțite de săgețile roșii sunt endoterme, implicând absorbția căldurii; în timp ce cei însoțiți de săgețile albastre sunt exotermi, eliberează căldură.
O scurtă descriere a fiecăreia dintre aceste modificări va fi făcută mai jos, subliniind unele dintre caracteristicile lor din raționamentul molecular și termodinamic..
- Fuziune
Fuziunea este schimbarea stării unei substanțe din solid în lichid..
În stare solidă particulele (ioni, molecule, clustere etc.) sunt „prizonieri”, situate în poziții fixe în spațiu fără a se putea mișca liber. Cu toate acestea, ele sunt capabile să vibreze la diferite frecvențe și, dacă sunt foarte puternice, ordinea riguroasă impusă de forțele intermoleculare va începe să „se destrame”..
Ca rezultat, se obțin două faze: una în care particulele rămân limitate (solide) și alta în care sunt mai libere (lichide), suficient pentru a crește distanțele care le separă. Pentru a realiza acest lucru, solidul trebuie să absoarbă căldura și astfel particulele sale vor vibra cu o forță mai mare..
Din acest motiv, fuziunea este endotermă și, atunci când începe, se spune că are loc un echilibru între fazele solid-lichid..
Căldura necesară pentru a da naștere acestei schimbări se numește căldură sau entalpie molară de fuziune (ΔHFus). Aceasta exprimă cantitatea de căldură (energie, în principal în unități de kJ) pe care un mol de substanță în stare solidă trebuie să o absoarbă pentru a se topi și nu pur și simplu să-și ridice temperatura..
Bulgare de zapada

Având în vedere acest lucru, se înțelege de ce un bulgăre de zăpadă se topește în mână (imaginea de sus). Zăpada absoarbe căldura corpului, ceea ce este suficient pentru a ridica temperatura zăpezii peste 0 ° C.
Cristalele de gheață din zăpadă absorb doar suficientă căldură pentru a se topi și pentru ca moleculele lor de apă să capete o structură mai dezordonată. În timp ce zăpada se topește, apa formată nu își va crește temperatura, deoarece toată căldura din mână este folosită de zăpadă pentru a-și finaliza topirea..
- Vaporizare

Vaporizarea este schimbarea stării unei substanțe din stare lichidă în stare gazoasă.
Continuând cu exemplul de apă, așezând acum o mână de zăpadă într-o oală și aprinzând focul, se observă că zăpada se topește rapid. Pe măsură ce apa se încălzește, în interiorul acesteia încep să se formeze bule mici de dioxid de carbon și alte posibile impurități gazoase..

Căldura extinde molecular configurațiile dezordonate ale apei, extinzându-și volumul și crescând presiunea de vapori; prin urmare, există mai multe molecule care scapă de la suprafață ca urmare a evaporării crescânde.
Apa lichidă își mărește temperatura încet, datorită căldurii sale specifice ridicate (4.184J / ° C ∙ g). Vine un moment în care căldura pe care o absoarbe nu mai este folosită pentru a-și crește temperatura, ci pentru a iniția echilibrul lichid-vapori; adică începe să fiarbă și tot lichidul va ajunge la starea gazoasă în timp ce absoarbe căldura și menține temperatura constantă.
Aici vedeți clocotul intens pe suprafața apei fierte (imaginea de sus). Căldura absorbită de apa lichidă, astfel încât presiunea de vapori a bulelor sale incipiente este egală cu presiunea externă, se numește entalpie de vaporizare (ΔHVapori).
Rolul presiunii
Presiunea este decisivă și în schimbările de stare. Care este efectul său asupra vaporizării? Cu cât presiunea este mai mare, cu atât este mai mare căldura pe care apa trebuie să o absoarbă pentru a fierbe și, prin urmare, vaporizează peste 100 ° C.
Acest lucru se datorează faptului că creșterea presiunii face dificilă evacuarea moleculelor de apă din lichid în faza gazoasă..
Aragazele sub presiune folosesc acest fapt în avantajul lor pentru a încălzi alimentele în apă la o temperatură peste punctul său de fierbere..
Pe de altă parte, deoarece există un vid sau o scădere a presiunii, apa lichidă are nevoie de o temperatură mai mică pentru a fierbe și pentru a intra în faza gazoasă. Cu o presiune mare sau mică, când apa fierbe, trebuie să-și absoarbă căldura de vaporizare respectivă pentru a finaliza schimbarea de stare..
- Condensare
Condensarea este schimbarea stării unei substanțe de la starea gazoasă la starea lichidă.

Apa s-a vaporizat. Ce urmeaza? Vaporii de apă își pot crește în continuare temperatura, devenind un curent periculos capabil să provoace arsuri grave..
Cu toate acestea, să presupunem că se răcește în schimb. Cum? Eliberarea de căldură în mediu și eliberarea de căldură se spune că este un proces exoterm care are loc.
Eliberând căldură, moleculele de apă gazoase foarte energice încep să încetinească. De asemenea, interacțiunile lor devin mai eficiente pe măsură ce temperatura aburului scade. Primele picături de apă se vor forma, condensate din abur, urmate de picături mai mari care ajung să fie atrase de gravitație.
Pentru a condensa complet o cantitate dată de abur, trebuie să eliberați aceeași energie, dar cu semn opus, la ΔHVapori; adică entalpia sa de condensare ΔHCond. Astfel, se stabilește echilibrul invers vapor-lichid.
Ferestre umede

Condensarea poate fi văzută chiar pe ferestrele caselor. Într-un climat rece, vaporii de apă conținuți în interiorul casei se ciocnesc de fereastră, care datorită materialului său are o temperatură mai scăzută decât alte suprafețe..
Acolo este mai ușor ca moleculele de vapori să se aglomereze, creând un strat subțire albicios ușor de îndepărtat manual. Pe măsură ce aceste molecule eliberează căldură (încălzind sticla și aerul), ele încep să formeze mai multe grupuri până când primele picături se pot condensa (imaginea de sus).
Când picăturile devin foarte mari, alunecă pe fereastră și lasă o urmă de apă.
- Solidificare
Solidificarea este schimbarea stării unei substanțe de la starea lichidă la starea solidă.

Solidificarea are loc ca urmare a răcirii; cu alte cuvinte, apa ingheata. Pentru a îngheța, apa trebuie să elibereze aceeași cantitate de căldură pe care gheața o absoarbe pentru a se topi. Din nou, această căldură se numește entalpia solidificării sau înghețului, ΔHCong (-ΔHFus).
Pe măsură ce moleculele de apă se răcesc, pierd energie și interacțiunile lor intermoleculare devin mai puternice și mai direcționale. Drept urmare, ele sunt aranjate datorită legăturilor lor de hidrogen și formează așa-numitele cristale de gheață. Mecanismul prin care cresc cristalele de gheață are un impact asupra aspectului lor: transparent sau alb.

Dacă cristalele de gheață cresc foarte încet, acestea nu exclud impuritățile, cum ar fi gazele care se dizolvă în apă la temperaturi scăzute. Astfel, bulele scapă și nu pot interacționa cu lumina; și, în consecință, aveți o gheață la fel de transparentă ca cea a unei statui de gheață extraordinare (imaginea de sus).
Același lucru care se întâmplă cu gheața, se poate întâmpla cu orice altă substanță care se solidifică prin răcire. Poate că aceasta este cea mai complexă schimbare fizică a condițiilor terestre, deoarece se pot obține mai multe polimorfe.
- Sublimarea
Sublimarea este schimbarea stării unei substanțe de la starea solidă la cea gazoasă.
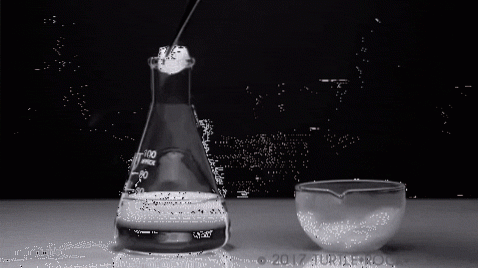
Se poate sublima apa? Nu, cel puțin nu în condiții normale (T = 25 ° C, P = 1 atm). Pentru a avea loc sublimarea, adică schimbarea stării de la solid la gaz, presiunea de vapori a solidului trebuie să fie ridicată.
De asemenea, este esențial ca forțele lor intermoleculare să nu fie foarte puternice, de preferință dacă sunt formate doar din forțe de dispersie.
Cel mai emblematic exemplu este iodul solid. Este un solid cristalin cu nuanțe cenușiu-violet, care prezintă o presiune ridicată a vaporilor. Atât de mult, încât în acțiunea acestuia se degajă un vapor purpuriu, al cărui volum și expansiune devin vizibile atunci când sunt supuse încălzirii.

Un experiment tipic este prezentat în imaginea de mai sus, unde iodul solid este evaporat într-un recipient de sticlă. Este interesant și izbitor să observăm modul în care vaporii purpurii sunt difuzați, iar elevul inițiat poate verifica absența iodului lichid.
Aceasta este principala caracteristică a sublimării: nu există prezența unei faze lichide. De asemenea, este endoterm, deoarece solidul absoarbe căldura pentru a-și crește presiunea de vapori până când este egal cu presiunea externă..
- Depunere

Depunerea este schimbarea stării unei substanțe de la starea gazoasă la starea solidă.
În paralel cu experimentul de sublimare a iodului, există și cel al depunerii sale. Depunerea este schimbarea sau tranziția opusă: substanța trece de la starea gazoasă la solid fără formarea unei faze lichide.
Când vaporii de iod violet intră în contact cu o suprafață rece, eliberează căldură pentru a o încălzi, pierzând energie și regrupându-și moleculele înapoi în solidul cenușiu-violet (imaginea de sus). Este apoi un proces exoterm.
Depunerea este utilizată pe scară largă pentru sinteza materialelor în care acestea sunt dopate cu atomi de metal prin tehnici sofisticate. Dacă suprafața este foarte rece, schimbul de căldură dintre aceasta și particulele de vapori este brusc, omițând trecerea prin faza lichidă respectivă..
Căldura sau entalpia depunerii (și nu depozit) este inversul sublimării (ΔHSub= - ΔHD.E.P). În teorie, multe substanțe pot fi sublimate, dar pentru a realiza acest lucru este necesar să se manipuleze presiunile și temperaturile, pe lângă faptul că au diagrama P vs T la îndemână; în care pot fi vizualizate fazele sale îndepărtate posibile.
Alte modificări de stare
Deși nu se face nicio mențiune asupra lor, există și alte stări ale materiei. Uneori, acestea se caracterizează prin faptul că au „câte puțin din fiecare” și, prin urmare, sunt o combinație a acestora. Pentru a le genera, presiunile și temperaturile trebuie manipulate la magnitudini foarte pozitive (mari) sau negative (mici)..
Astfel, de exemplu, dacă gazele sunt încălzite excesiv, își vor pierde electronii și nucleii lor încărcați pozitiv în acea maree negativă vor constitui ceea ce este cunoscut sub numele de plasmă. Este sinonim cu „gaz electric”, deoarece are o conductivitate electrică ridicată.
Pe de altă parte, atunci când temperaturile scad prea mult, materia se poate comporta în moduri neașteptate; adică prezintă proprietăți unice în jurul valorii de zero absolut (0 K).
Una dintre aceste proprietăți este superfluiditatea și supraconductivitatea; precum și formarea condensatelor Bose-Einstein, unde toți atomii se comportă ca unul singur.
Unele cercetări indică chiar materia fotonică. În ele, particulele de radiație electromagnetică, fotoni, se grupează pentru a forma molecule fotonice. Adică ar da masă corpurilor de lumină, teoretic.
Referințe
- Helmenstine, Anne Marie, dr. (19 noiembrie 2018). Lista modificărilor de fază între stările de materie. Recuperat de pe: thoughtco.com
- Wikipedia. (2019). Stare a materiei. Recuperat de pe: en.wikipedia.org
- Dorling Kindersley. (2007). Schimbarea stărilor. Recuperat de pe: factmonster.com
- Meyers Ami. (2019). Schimbare de fază: evaporare, condensare, înghețare, topire, sublimare și depunere. Studiu. Recuperat de la: study.com
- Bagley M. (11 aprilie 2016). Materie: definiție și cele cinci state ale materiei. Recuperat de pe: livescience.com
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.



Nimeni nu a comentat acest articol încă.