
Structura carbonatului de calciu, proprietăți, formare, utilizări
carbonat de calciu este un compus anorganic a cărui formulă chimică este CaCO3. Se găsește în principal în minerale precum calcitul și aragonitul. De asemenea, alcătuiește calcarul, o rocă sedimentară în care este prezent calcitul mineral..
Acest important carbonat metalic se obține industrial prin extracția și măcinarea mineralelor care îl conțin; marmura este folosită în principal în acest scop. Un alt proces constă în utilizarea oxidului de calciu, care este transformat în hidroxid de calciu, precipitând carbonat de calciu din acesta prin adăugarea de dioxid de carbon. În acest fel, se obțin cristale cu o gamă largă de dimensiuni..

Ele pot fi utilizate și pentru producția industrială de CaCO3, la scară mică, scoici de scoici, coji de ouă și coji de stridii în care este prezentă.
Carbonatul de calciu prezent în calcar este dizolvat de dioxidul de carbon în apă, generând bicarbonat de calciu. Această acțiune poate provoca caverne și este o cauză a alcalinizării apei; eveniment de mare importanță în menținerea vieții în el.
A fost folosit în construcția și elaborarea de sculpturi; exemple în acest sens sunt Partenonul din Atena, Catedrala din Cracovia și sculptura lui Abraham Lincoln din Washington. Cu toate acestea, susceptibilitatea sa la ploi acide și-a redus utilizarea în construcții..
Carbonatul de calciu a avut multiple aplicații în industrie ca material de umplutură din plastic și hârtie. În medicină a fost utilizat pentru controlul acidității gastrice; ca supliment alimentar de calciu; pentru a controla fosfatemia la pacienții cu insuficiență renală cronică etc..
Indice articol
- 1 Structură
- 1.1 Duritatea proteinelor
- 2 Proprietăți
- 2.1 Alte denumiri
- 2.2 Masa molară
- 2.3 Descrierea fizică
- 2.4 Aromă
- 2.5 Puncte de topire și fierbere
- 2.6 Solubilitate
- 2.7 Densitate
- 2.8 Descompunerea
- 2,9 pH
- 2.10 Indicele de refracție
- 2.11 Incompatibilități
- 2.12 Entalpia de fuziune
- 2.13 Constanta produsului de solubilitate
- 2.14 Duritate
- 2.15 Tranziții de fază
- 2.16 Reactivitate
- 3 Instruire
- 4 Forme de carbonat de calciu
- 5 utilizări
- 5.1 Industrial
- 5.2 Medici
- 5.3 Altele
- 6 Referințe
Structura
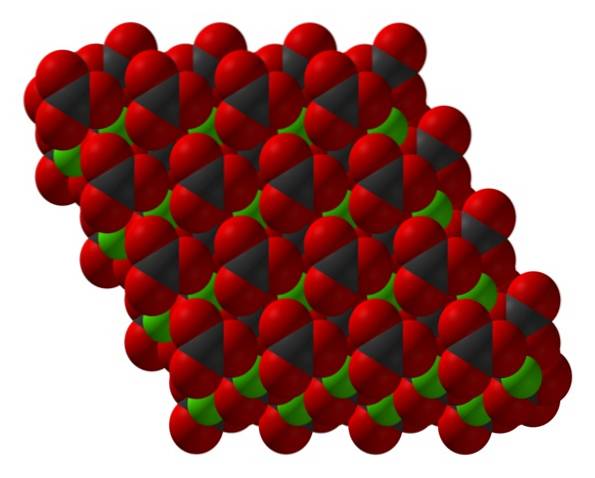
Formula carbonatului de calciu, CaCO3, indică faptul că raportul ionilor de Ca.Două+ și CO3Două- este 1: 1; adică pentru fiecare Ca.Două+ există un CO3Două- omologul interacționând electrostatic cu acesta. Astfel, legătura ionică ajunge să aranjeze acești ioni pentru a forma modele structurale care definesc un cristal..
Imaginea superioară arată structura CaCO3. Sferele verzi corespund cationilor CaDouă+, iar sferele roșii și negre către anionii CO3Două-. Rețineți că structura pare a fi alcătuită din mai multe straturi: unul de calciu, iar celălalt de carbonat; ceea ce înseamnă că cristalizează într-o structură hexagonală compactă.
Această fază hexagonală (β-CaCO3) corespunde unui polimorf. Există alte două: ortorombicul (λ-CaCO3) și un hexagonal și mai dens (μ-CaCO3). Imaginea de mai jos vă ajută să vizualizați mai bine hexagonul fericit:
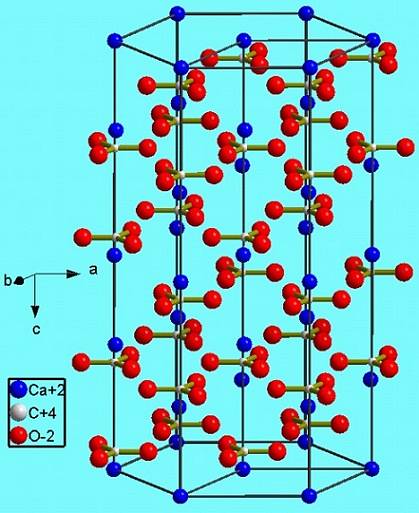
Cu toate acestea, în funcție de temperatură (și pentru această sare într-un grad mai mic presiunea), ionii din vibrațiile lor se adaptează la alte structuri; acestea sunt polimorfii deja menționați (β, λ și μ).
După cum sună, nu sunt foarte cunoscuți, cu excepția cazului în care sunt menționați cu numele lor mineralogice într-o secțiune viitoare.
Duritatea proteinelor
Cristale de CaCO3 Nu sunt singuri: pot găzdui impurități precum alți cationi metalici care le colorează; sau proteine, încorporând o matrice organică care contribuie cumva la duritatea sa naturală.
Proteinele reduc tensiunea pe care cristalele o experimentează una împotriva celeilalte sub presiune sau impact. Cum? Când este blocat între cristale, acționând ca și cum ar fi un "tampon" (similar cu setul de cărămidă-ciment-cărămidă).
De aceea acest compus sau mineral este biocompatibil și nu este surprinzător faptul că face parte din unghii, scoici, scoici sau oase de arici. A fost o sursă de inspirație pentru cei dedicați dezvoltării de noi materiale.
Proprietăți
Alte nume
-Aragonit
-Calcit
-Volterito
-Laptele de calciu
-Tablă albă
-Marmură
Masă molară
100,086 g / mol.
Descriere Fizica
Pulbere albă inodoră.
Gust
Asemănător cretei, fără gust.
Puncte de topire și fierbere
Se descompune datorită eliberării de CODouă înainte chiar să se topească sau să fiarbă.
Solubilitate
Practic insolubil în apă și alcool. Se dizolvă efervescent în acizi acetici și clorhidri diluați. Hidroxizii reduc totuși solubilitatea acestuia. Între timp, sărurile de amoniu și dioxidul de carbon cresc solubilitatea carbonatului de calciu în apă..
Densitate
2,7 până la 2,95 g / cm3.
Descompunere
La aproximativ 825 ºC se descompune în oxid de calciu (var) și dioxid de carbon (CODouă).
pH
8-9
Indicele de refracție
-1,7216 la 300 nm și 1,6584 la 589 nm (calcit).
-1,5145 la 300 nm și 1,4864 la 589 nm (aragonit).
Incompatibilități
Cu acizi, alum și săruri de amoniu.
Entalpia de fuziune
36 kJ / mol la 800 ºC (calcit).
Solubilitate produs constant
3.36 10-9 la 25 ° C.
Duritate
-3,0 (calcit)
-3,5 - 4,0 (aragonit) pe scara Mohs.
Tranziții de fază
Aragonitul este metastabil și se transformă ireversibil în calcit atunci când este încălzit în aer uscat la 400 ° C..
Reactivitate
Carbonatul de calciu reacționează cu acizii, eliberând dioxid de carbon, calciu ionic și apă..
Carbonatul de calciu se combină cu apa saturată cu dioxid de carbon, echivalent cu acidul carbonic (HDouăCO3), pentru a forma bicarbonat de calciu.
Instruire
Creta, marmura și calcarul, primele două minerale și un material stâncos al treilea, conțin carbonat de calciu și sunt de origine sedimentară. Se crede că s-au format prin sedimentarea melcilor de-a lungul a milioane de ani..
PH ar putea fi cel mai important factor în formarea polimorfilor la o temperatură de 24 ° C. Vateritul este produsul principal într-un interval de pH cuprins între 8,5 și 10; aragonitul este la pH 11; și calcit la pH> 12.
De asemenea, multe alge de apă dulce sunt cunoscute pentru a construi cristale de calcit atunci când sunt cultivate într-un mediu saturat de calciu. În plus, microalge sunt capabile să provoace precipitarea carbonatului de calciu.
Forme de carbonat de calciu
Imaginile de mai jos vor arăta cele trei forme principale sau polimorfe pentru carbonatul de calciu:



De sus în jos sunt polimorfii calcit, aragonit și vaterit. Observați la prima vedere diferența dintre morfologia cristalelor sale (culoarea este tipică originilor și caracteristicilor din împrejurimi).
Vateritul este mai opac decât calcitul, acesta din urmă devenind chiar complet transparent (spart islandez) și, prin urmare, a fost utilizat în bijuterii și aplicații optice. Între timp, cristalele de aragonit seamănă cu mici monolite alungite.
Dacă se observă probe din aceste trei polimorfe la microscopul electronic, cristalele acestora (cu tonuri cenușii datorită faptului că tehnica nu permite rezoluția culorii), aceleași morfologii ar fi găsite ca la scările macroscopice; adică dintr-o privire.
Dintre aceste trei polimorfe, calcitul este cel mai abundent și stabil, urmat de aragonit și, în cele din urmă, vaterit, cea mai rară dintre formele de CaCO3
Aplicații
Industrial
Carbonatul de calciu crește rezistența la torsiune și tracțiune a cauciucului sintetic și natural, menținându-și flexibilitatea. Este utilizat în industria construcțiilor ca ingredient în ciment și ca materie primă pentru var. Utilizarea sa a fost redusă deoarece este deteriorată de ploile acide.
Carbonatul de calciu este utilizat în purificarea fierului. Sub formă de var, îndepărtează dioxidul de sulf prezent în metal. Se folosește la purificarea zahărului din sfeclă. A fost cândva folosit ca cretă de tablă, dar a fost înlocuit cu tencuială pentru această aplicație.
Carbonatul de calciu este amestecat cu chitul care este utilizat la instalarea sticlei. Pământul este folosit ca material de umplutură în filmul microporos utilizat în scutece. Este, de asemenea, utilizat ca material de umplutură în materiale plastice, cum ar fi PVC. În plus, crește rezistența plasticului.
Carbonatul de calciu este utilizat pentru a crește capacitatea de acoperire a vopselelor. Este folosit ca material de umplere a hârtiei, deoarece este mai ieftin decât fibra de lemn și poate reprezenta mai mult de 10% din hârtie.
Medici
Este utilizat ca antiacid pentru combaterea hiperacidității gastrice și ameliorarea indigestiei. Este utilizat ca supliment alimentar de calciu și în tratamentul și prevenirea osteoporozei. Este utilizat în tratamentul hiperfosfatemiei la pacienții cu insuficiență renală cronică..
A fost utilizat pentru a reduce efectele nedorite ale inhibitorilor de protează utilizați în tratamentul HIV, observându-se o reducere a diareei la pacienți..
Produce o scădere a tensiunii arteriale la femeile gravide cu hipertensiune și preeclampsie, deoarece ambele ar putea fi asociate cu o cerere crescută de calciu datorită prezenței fetale.
Alții
Carbonatul de calciu este utilizat în agricultură ca îngrășământ și pentru combaterea acidității solului. Se folosește ca conservant, pentru păstrarea culorii și pentru alimentația fermă.
În plus, este un ingredient în pasta de dinți și servește ca un abraziv sub formă de pulbere în curățare și spălare..
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Carbonat de calciu. Recuperat de pe: en.wikipedia.org
- Centrul Național pentru Informații despre Biotehnologie. (2019). Carbonat de calciu. Baza de date PubChem., CID = 10112. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Kai-Yin Chong, Chin-Hua Chia și Sarani Zakaria. (2014). Polimorfizează carbonatul de calciu la reacția la temperatură. Procesele Conferinței AIP 1614, 52; doi.org/10.1063/1.4895169
- Greg Watry. (1 noiembrie 2016). Descoperind modul în care cristalele de carbonat de calciu capătă putere. Marketing de afaceri cu avantaje. Recuperat de pe: rdmag.com
- Elemente americane. (2019). Carbonat de calciu. Recuperat de pe: americanelements.com
- ElSevier. (2019). Carbonat de calciu. ScienceDirect. Recuperat de pe: sciencedirect.com
- Carte chimică. (2017). Carbonat de calciu. Recuperat de pe: chemicalbook.com



Nimeni nu a comentat acest articol încă.