
Structura, proprietățile, producția, utilizările carburii de calciu (CaC2)

carbura de calciu Este un compus anorganic format din elementele calciu (Ca) și carbon (C). Formula sa chimică este CaCDouă. Este un solid care poate fi incolor până la gălbuie sau alb cenușiu, și chiar negru, în funcție de impuritățile pe care le conține.
Una dintre cele mai importante reacții chimice ale acestuiaDouă este ceea ce se întâmplă cu apa HDouăSau, în care se formează acetilenă HC≡CH. Din acest motiv se folosește pentru obținerea acetilenei într-un mod industrial. Datorită aceleiași reacții cu apa, se folosește la coacerea fructelor, în arme false și în flăcări navale..

Reacția CaCDouă cu apă produce, de asemenea, un nămol util pentru prepararea clincherului (un component al cimentului), care produce mai puțin dioxid de carbon (CODouă) în comparație cu metoda tradițională de producere a cimentului.
Cu azot (NDouă) carbura de calciu formează cianamida de calciu, care este utilizată ca îngrășământ. CaCDouă este folosit și pentru îndepărtarea sulfului din anumite aliaje metalice.
Cu ceva timp în urmă, CaCDouă A fost folosit în așa-numitele lămpi din carbură, dar acestea nu mai sunt foarte frecvente, deoarece sunt periculoase.
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Punctul de fierbere
- 3.5 Densitate
- 3.6 Proprietăți chimice
- 4 Obținerea
- 5 utilizări
- 5.1 În producția de acetilenă
- 5.2 În reducerea emisiilor de CO2
- 5.3 La obținerea cianamidei de calciu
- 5.4 În industria metalurgică
- 5.5 În diverse utilizări
- 5.6 Utilizarea întreruptă
- 6 Riscuri
- 7 Referințe
Structura
Carbura de calciu este un compus ionic și este alcătuită din ionul de calciu CaDouă+ iar ionul de carbură sau acetilură CDouăDouă-. Ionul carbură este alcătuit din doi atomi de carbon uniți printr-o legătură triplă.
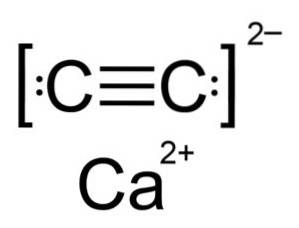
Structura cristalină a CaCDouă este derivat din cub (cum ar fi clorura de sodiu NaCl), dar ca ionul CDouăDouă- este alungită structura este distorsionată și devine tetragonală.
Nomenclatură
- Carbid de calciu
- Carbura de calciu
- Acetilură de calciu
Proprietăți
Starea fizică
Solid cristalin care, atunci când este pur, este incolor, dar dacă este contaminat cu alți compuși, poate fi alb gălbui sau cenușiu până la negru.

Greutate moleculară
64,0992 g / mol
Punct de topire
2160 ºC
Punct de fierbere
CaCDouă fierbe la 2300 ºC cu descompunere. Punctul de fierbere trebuie măsurat într-o atmosferă inertă, adică fără oxigen sau umiditate..
Densitate
2,22 g / cm3
Proprietăți chimice
Carbura de calciu reacționează cu apa pentru a forma acetilenă HC≡CH și hidroxid de calciu Ca (OH)Două:
CaCDouă + 2 oreDouăO → HC≡CH + Ca (OH)Două
Acetilena este inflamabilă, deci CaC în prezența umiditățiiDouă poate fi inflamabil. Cu toate acestea, atunci când este uscat, nu este.

Carbura de calciu reacționează cu azotul NDouă pentru a forma cianamidă de calciu CaCNDouă:
CaCDouă + NDouă → CaCNDouă + C
Obținerea
Carbura de calciu este produsă industrial într-un cuptor cu arc electric pornind de la un amestec de carbonat de calciu (CaCO3) și carbon (C) care este supus la o temperatură de 2000 ° C. Reacția este rezumată astfel:
Hoţ3 + 3 C → CaCDouă + CO ↑ + CODouă↑
Sau, de asemenea:
CaO + 3 C → CaCDouă + CO ↑
Într-un cuptor cu arc electric se produce un arc de electricitate între doi electrozi de grafit, care rezistă temperaturilor ridicate care se formează. Se obține o carbură de calciu cu puritate de 80-85%.
Aplicații
În producția de acetilenă
Industrial, reacția carburii de calciu cu apa este utilizată pentru a produce acetilenă CDouăHDouă.
CaCDouă + 2 oreDouăO → HC≡CH + Ca (OH)Două
Aceasta este cea mai importantă utilizare a carburii de calciu. În unele țări, acetilena este foarte apreciată, deoarece face posibilă producerea clorurii de polivinil, care este un tip de plastic. În plus, acetilena este utilizată pentru sudarea la temperaturi ridicate.

În reducerea emisiilor de CODouă
Resturile obținute din obținerea acetilenei începând de la CaCDouă (numit și „nămol de carbură de calciu” sau „reziduuri de carbură de calciu”) sunt utilizate pentru obținerea clincherului sau a betonului.
Nămolul din carbură de calciu are un conținut ridicat de hidroxid de calciu (Ca (OH)Două) (aproximativ 90%), o parte din carbonat de calciu (CaCO3) și are un pH mai mare de 12.

Din aceste motive poate reacționa cu SiODouă sau AlDouăSAU3 formând un produs similar cu cel obținut prin procesul de hidratare a cimentului.
Una dintre activitățile umane care produce cele mai multe emisii de CODouă este industria construcțiilor. CODouă se generează spre est se detașează de carbonatul de calciu în timpul reacției pentru a forma beton.
Utilizarea nămolului de carbură de calciu pentru a înlocui carbonatul de calciu (CaCO3) s-a constatat că reduce emisiile de CODouă cu 39%.
În obținerea cianamidei de calciu
Carbura de calciu este, de asemenea, utilizată industrial pentru a obține cianamidă de calciu CaCNDouă.
CaCDouă + NDouă → CaCNDouă + C
Cianamida de calciu este folosită ca îngrășământ, deoarece odată cu apa din sol este transformată în cianamidă H2N = C = N, care furnizează azot plantelor, un nutrient esențial pentru acestea.
În industria metalurgică
Carbura de calciu este utilizată pentru îndepărtarea sulfului din aliaje precum feronickelul. CaC este amestecatDouă cu aliajul topit la 1550 ° C. Sulful (S) reacționează cu carbura de calciu și produce sulfură de calciu CaS și carbon C:
CaCDouă + S → 2 C + CaS
Eliminarea sulfului este favorizată dacă amestecarea este eficientă și conținutul de carbon din aliaj este redus. Sulfura de calciu CaS pluteste pe suprafata aliajului topit de unde este decantat si aruncat..
În diverse utilizări
Carbura de calciu a fost folosită pentru îndepărtarea sulfului din fier. De asemenea, ca combustibil în producția de oțel și ca un puternic deoxidant.
Se folosește pentru coacerea fructelor. Acetilena este generată din carbură de calciu cu apă, ceea ce induce maturarea fructelor, cum ar fi bananele..

Carbura de calciu este utilizată în armele fictive pentru a provoca zgomot puternic care le caracterizează. Aici se folosește și formarea acetilenei, care explodează cu o scânteie în interiorul dispozitivului.
CaCDouă folosit pentru a genera semnale în larg în rachete navale cu autoaprindere.
Utilizare întreruptă
CaCDouă a fost folosit în așa-numitele lămpi din carbură. Funcționarea acestora constă în picurarea apei pe carbură de calciu pentru a forma acetilena, care se aprinde și în acest fel oferă lumină.
Aceste lămpi au fost utilizate în minele de cărbune, dar utilizarea lor a fost întreruptă din cauza prezenței gazului metan CH4 în aceste mine. Acest gaz este inflamabil și flacăra din lampa din carbură poate provoca aprinderea sau explozia acestuia..

Au fost utilizate pe scară largă în minele de ardezie, cupru și staniu, precum și în automobilele, motocicletele și bicicletele timpurii, ca faruri sau faruri.
În prezent, acestea au fost înlocuite de lămpi electrice sau chiar lămpi cu LED-uri. Cu toate acestea, acestea sunt încă utilizate în țări precum Bolivia, în minele de argint din Potosí.
Riscuri
Carbura de calciu CaCDouă uscat nu este inflamabil, dar în prezența umidității formează rapid acetilenă, care este.
Pentru a stinge un incendiu în prezența CaCDouă stingătoarele cu apă, spumă, dioxid de carbon sau halogen nu trebuie utilizate niciodată. Trebuie utilizat nisip sau hidroxid de sodiu sau calciu.
Referințe
- Ropp, R.C. (2013). Grupul 14 (C, Si, Ge, Sn și Pb) Compuși alcalini pământici. Carburi de calciu. În Enciclopedia compușilor alcalini ai pământului. Recuperat de la sciencedirect.com.
- Pohanish, R. P. (2017). C. Carbura de calciu. În Manualul Sittig de produse chimice și cancerigene toxice și periculoase (ediția a șaptea). Recuperat de la sciencedirect.com.
- Sun, H. și colab. (2015). Proprietățile reziduurilor din carbură de calciu combustibilă chimic și influența sa asupra proprietăților cimentului. Materiale 2015, 8, 638-651. Recuperat de la ncbi.nlm.nih.gov.
- Nie, Z. (2016). Evaluarea materialelor ecologice și a ciclului de viață. Studiu de caz: CODouă Analiza emisiilor clincherului de nămol din carbură de calciu. În fabricarea ecologică și durabilă a materialelor avansate. Recuperat de la sciencedirect.com.
- Crundwell, F.K. Et al. (2011). Rafinarea feronickelului topit. Îndepărtarea sulfului. În metalurgia extractivă a metalelor din grupul nichel, cobalt și platină. Recuperat de la sciencedirect.com.
- Tressler, R.E. (2001). Ceramică structurală și termostructurală. Carburi. În Enciclopedia științei și tehnologiei materialelor. Recuperat de la sciencedirect.com.
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.



Nimeni nu a comentat acest articol încă.