
Componentele celulelor electrochimice, modul lor de funcționare, tipuri, exemplu
celule electrochimice Sunt dispozitive în care au loc reacții chimice în care energia chimică este transformată în energie electrică sau invers. Aceste celule alcătuiesc inima electrochimiei, sufletul fiind schimbul potențial de electroni care poate avea loc, spontan sau nu, între două specii chimice..
Una dintre cele două specii se oxidează, pierde electroni, în timp ce cealaltă este redusă, câștigând electronii transferați. În mod obișnuit, specia redusă este un cation metalic în soluție, care prin câștigarea electronilor ajunge să fie depus electric pe un electrod din același metal. Pe de altă parte, specia care se oxidează este un metal, transformându-se în cationi metalici.
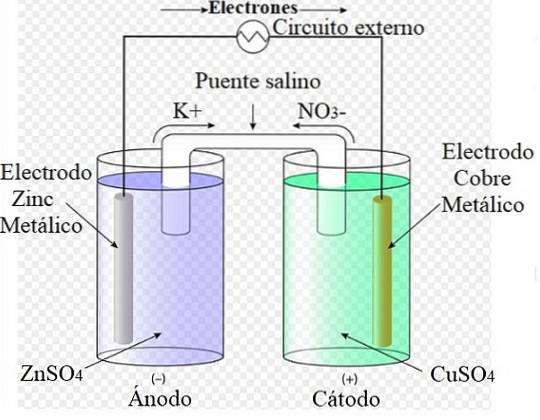
De exemplu, imaginea de mai sus reprezintă celula lui Daniel: cea mai simplă dintre toate celulele electrochimice. Electrodul metalic de zinc se oxidează, eliberând cationi ZnDouă+ la mediul apos. Acest lucru se întâmplă în containerul ZnSO4 pe stanga.
În dreapta, soluția care conține CuSO4 este redus, transformând cationii CuDouă+ în cupru metalic care se depune pe electrodul de cupru. În timpul dezvoltării acestei reacții, electronii se deplasează printr-un circuit extern activându-i mecanismele; și, prin urmare, furnizarea de energie electrică pentru funcționarea unei echipe.
Indice articol
- 1 Componente ale celulelor electrochimice
- 1.1 Electrozi
- 1.2 Dizolvarea electroliților
- 1.3 Podul de sare
- 2 Tipuri de celule electrochimice și modul lor de funcționare
- 2.1 Galvanic
- 2.2 Electrolitice
- 3 Exemple
- 3.1 Chilia lui Daniel
- 3.2 Celula de platină și hidrogen
- 3.3 Celula Downs
- 4 Referințe
Componente electrochimice ale celulei
Electrozi
Curenții electrici sunt generați sau consumați în celulele electrochimice. Pentru a asigura un flux adecvat de electroni trebuie să existe materiale care să fie bune conductoare de electricitate. Aici intră electrozii și circuitul extern, prevăzute cu cabluri de cupru, argint sau aur..
Electrozii sunt materialele care asigură suprafața în care vor avea loc reacțiile în celulele electrochimice. Există două tipuri în funcție de reacția care apare în ele:
-Anod, electrod unde are loc oxidarea
-Catod, electrod unde are loc reducerea
Electrozii pot fi confecționați dintr-un material care reacționează, ca în cazul celulei lui Daniel (zinc și cupru); sau un material inert, cum ar fi atunci când sunt realizate din platină sau grafit.
Electronii eliberați de anod trebuie să ajungă la catod; dar nu printr-o soluție, ci printr-un cablu metalic care unește ambii electrozi cu un circuit extern.
Dizolvarea electrolitelor
Soluția care înconjoară electrozii joacă, de asemenea, un rol important, deoarece este îmbogățită cu electroliți puternici; precum: KCl, KNO3, NaCl etc. Acești ioni favorizează, într-o anumită măsură, migrația electronilor de la anod la catod, precum și conducerea lor prin vecinătatea electrozilor pentru a interacționa cu speciile care urmează să fie reduse..
Apa de mare, de exemplu, conduce electricitatea mult mai bine decât apa distilată, cu o concentrație de ioni mai mică. De aceea, celulele electrochimice au o dizolvare de electroliți puternici printre componentele lor..
Pod salin
Ionii soluției încep să înconjoare electrozii provocând polarizarea sarcinilor. Soluția din jurul catodului începe să devină încărcată negativ, pe măsură ce cationii sunt reduși; în cazul celulei lui Daniel, cationii CuDouă+ prin depunerea ca cupru metalic pe catod. Astfel, începe să existe un deficit de taxe pozitive.
Aici intervine puntea de sare pentru a echilibra sarcinile și a preveni polarizarea electrozilor. Spre partea laterală sau compartimentul catodului, cationii vor migra de pe puntea de sare, fie K+ sau ZnDouă+, a înlocui CuDouă+ consumat. Între timp, NICI anioni nu vor migra de pe podul de sare3- spre compartimentul anodic, pentru a neutraliza concentrația crescândă a cationilor ZnDouă+.
Puntea de sare este compusă dintr-o soluție saturată de săruri, cu capetele acoperite de un gel permeabil la ioni, dar impermeabil la apă..
Tipuri de celule electrochimice și modul lor de funcționare
Cum funcționează o celulă electrochimică depinde de ce tip este. În principiu există două tipuri: galvanic (sau voltaic) și electrolitic.
Galvanic
Celula lui Daniel este un exemplu de celulă electrochimică galvanică. În ele reacțiile apar spontan și potențialul bateriei este pozitiv; cu cât potențialul este mai mare, cu atât celula va furniza mai multă energie electrică.
Celulele sau bateriile sunt exact celule galvanice: potențialul chimic dintre cei doi electrozi este transformat în energie electrică atunci când intervine un circuit extern care le conectează. Astfel, electronii migrează din anod, aprind echipamentul la care este conectată bateria și sunt returnați direct la catod.
Electrolitic
Celulele electrolitice sunt acelea ale căror reacții nu apar spontan, decât dacă sunt alimentate cu energie electrică dintr-o sursă externă. Aici apare fenomenul opus: electricitatea permite să se dezvolte reacții chimice non-spontane.
Una dintre cele mai cunoscute și mai valoroase reacții care are loc în cadrul acestui tip de celulă este electroliza..
Bateriile reîncărcabile sunt exemple de celule electrolitice și în același timp galvanice: sunt reîncărcate pentru a inversa reacțiile lor chimice și pentru a restabili condițiile inițiale care urmează să fie reutilizate..
Exemple
Chilia lui Daniel
Următoarea ecuație chimică corespunde reacției din celula lui Daniel la care participă zincul și cuprul:
Zn (s) + CuDouă+(aq) → ZnDouă+(aq) + Cu (s)
Dar cationii CuDouă+ și ZnDouă+ nu sunt singuri, ci sunt însoțiți de anioni SO4Două-. Această celulă poate fi reprezentată după cum urmează:
Zn | ZnSO4 | | CURS4 | Cu
Celula lui Daniel poate fi construită în orice laborator, fiind foarte recurentă ca practică în introducerea electrochimiei. Deoarece CuDouă+ se depune sub formă de Cu, culoarea albastră a soluției de CuSO4 va fi pierdut.
Celula de hidrogen de platină
Imaginați-vă o celulă care consumă hidrogen gazos, produce argint metalic și, în același timp, furnizează energie electrică. Aceasta este celula de platină și hidrogen, iar reacția sa generală este următoarea:
2AgCl (s) + HDouă(g) → 2Ag (s) + 2H+ + 2Cl-
Aici, în compartimentul anodic avem un electrod de platină inert, scufundat în apă și în care este pompat hidrogen gazos. HDouă se oxidează la H+ și dă electronii precipitatului AgCl lăptos din compartimentul catodic cu un electrod metalic de argint. Pe acest argint, AgCl va fi redus și masa electrodului va crește..
Această celulă poate fi reprezentată ca:
Pt, HDouă | H+ | | Cl-, AgCl | Ag
Celula Downs
Și, în cele din urmă, printre celulele electrolitice avem celula de clorură de sodiu topită, mai bine cunoscută sub numele de celula Downs. Aici, electricitatea este utilizată astfel încât un volum de NaCI topit să treacă prin electrozi, provocând astfel următoarele reacții:
2Na+(l) + 2e- → 2Na (s) (catod)
2Cl-(l) → ClDouă(g) + 2e- (anod)
2NaCl (l) → 2Na (s) + ClDouă(g) (reacție globală)
Astfel, datorită electricității și clorurii de sodiu, pot fi preparate sodiu metalic și clor gazos..
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Wikipedia. (2020). Celulă electrochimică. Recuperat de pe: en.wikipedia.org
- Helmenstine, Anne Marie, dr. (29 ianuarie 2020). Celule electrochimice. Recuperat de pe: thoughtco.com
- R. Nava. (s.f.). Celule electrochimice. Recuperat de la: hyperphysics.phy-astr.gsu.edu
- Chemicool. (2017). Definiția celulei electrochimice. Recuperat de pe: chemicool.com
- Patricia Jankowski. (2020). Ce este o celulă electrochimică? - Structură și utilizări. Studiu. Recuperat de la: study.com
- Alchimie (3 martie 2011). Celule electrochimice. Chimie și Știință. Recuperat de la: laquimicaylaciencia.blogspot.com



Nimeni nu a comentat acest articol încă.