
Caracteristicile cicloalcinelor, aplicații, exemple
cicloalchine Sunt compuși organici care au una sau mai multe triple legături și o unitate ciclică. Formulele sale moleculare condensate respectă formula CnH2n-4. Astfel, dacă n este egal cu 3, atunci formula respectivei cicloalchine va fi C3HDouă.
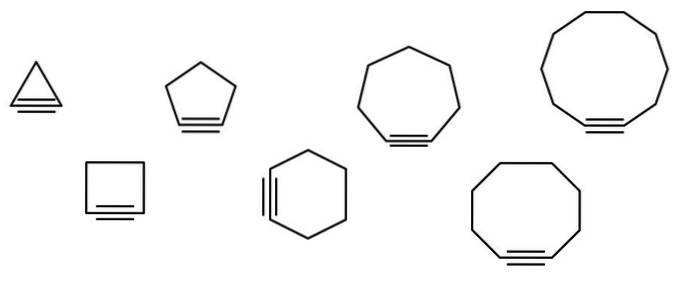
O serie de figuri geometrice sunt ilustrate în imaginea de mai jos, dar constau de fapt în exemple de cicloalchine. Fiecare dintre ele poate fi considerat ca o versiune mai oxidată a cicloalcanilor respectivi (fără legături duble sau triple). Când le lipsește un heteroatom (O, N, S, F etc.), ele sunt doar hidrocarburi „simple”..
Chimia din jurul cicloalcinelor este foarte complexă, iar mecanismele din spatele reacțiilor lor sunt și mai complexe. Ele reprezintă un punct de plecare pentru sinteza multor compuși organici, care la rândul lor sunt supuși unor posibile aplicații.
În general vorbind, acestea sunt extrem de reactive, cu excepția cazului în care sunt „distorsionate” sau complexate cu metale de tranziție. La fel, legăturile sale triple pot fi conjugate cu legături duble, creând unități ciclice în cadrul moleculelor..
Dacă nu este cazul, în structurile lor cele mai simple sunt capabili să adauge molecule mici la legăturile lor triple..
Indice articol
- 1 Caracteristicile cicloalcinelor
- 1.1 Apolaritatea și legătura triplă
- 1.2 Forțe intermoleculare
- 1.3 Stresul unghiular
- 2 Nomenclatură
- 3 Aplicații
- 4 Exemple
- 5 Referințe
Caracteristicile cicloalcinelor
Apolaritatea și legătura triplă
Cicloalchinele se caracterizează prin faptul că sunt molecule apolare și, prin urmare, sunt hidrofobe. Acest lucru se poate schimba dacă în structurile lor au un anumit heteroatom sau grup funcțional care le oferă un moment dipolar considerabil; așa cum se întâmplă în heterocicluri cu legături triple.
Dar ce este o legătură triplă? Nu sunt mai mult de trei interacțiuni simultane între doi atomi de carbon cu hibridizare sp. O legătură este simplă (σ), iar celelalte două π, perpendiculare una pe cealaltă. Ambii atomi de carbon au un orbital sp liber pentru a se lega cu alți atomi (R-C≡C-R).
Acești orbitali hibrizi au 50% s caracter și 50% p caracter. Deoarece orbitalele s sunt mai pătrunzătoare decât cele p, acest fapt face ca cei doi carboni ai legăturii triple să fie mai acizi (acceptori de electroni) decât carbonii alcanilor sau alchenelor..
Din acest motiv, legătura triplă (≡) reprezintă un punct specific pentru care speciile donatoare de electroni se adaugă la aceasta, formând legături simple..
Aceasta are ca rezultat ruperea uneia dintre legăturile π, devenind o legătură dublă (C = C). Adăugarea continuă până la R4C-CR4, adică carboni complet saturați.
Cele de mai sus pot fi explicate și în acest fel: tripla legătură este o dublă nesaturare.
Forte intermoleculare
Moleculele de cicloalchină interacționează prin forțe de împrăștiere sau forțe londoneze și prin interacțiuni de tip π-π. Aceste interacțiuni sunt slabe, dar pe măsură ce mărimea ciclurilor crește (la fel ca ultimele trei din partea dreaptă a imaginii), reușesc să formeze solide la temperatura și presiunea camerei..
Stresul unghiular
Legăturile din legătura triplă sunt situate pe același plan și o linie. Prin urmare, -C≡C- are o geometrie liniară, cu orbitalele sp separate de aproximativ 180º.
Acest lucru are o implicație gravă asupra stabilității stereochimice a cicloalcinelor. Este nevoie de multă energie pentru a „îndoi” orbitalii sp, deoarece nu sunt flexibili.
Cu cât cicloalchina este mai mică, cu atât orbitalii sp trebuie să se îndoaie mai mult pentru a permite existența sa fizică. Analizând imaginea, se poate observa, de la stânga la dreapta, că în triunghi unghiul legăturilor către laturile legăturii triple este foarte pronunțat; în timp ce în decagon sunt mai puțin abrupte.
Cu cât cicloalcina este mai mare, cu atât unghiul de legătură al orbitalelor sp se apropie de 180º ideal. Opusul apare atunci când sunt mai mici, forțându-i să se îndoaie și creând un stres unghiular în ele, destabilizând cicloalchina.
Astfel, cicloalcinele mai mari au stres unghiular mai mic, ceea ce permite sinteza și stocarea lor. Cu aceasta, triunghiul este cea mai instabilă cicloalchină, iar decagonul cel mai stabil dintre toate..
De fapt, ciclooctino (cel cu octagonul) este cea mai mică și stabilă mărime cunoscută; ceilalți există doar ca intermediari de moment în reacțiile chimice.
Nomenclatură
Aceleași standarde IUPAC ca și pentru cicloalcani și cicloalcene trebuie aplicate la denumirea de cicloalchine. Singura diferență constă în sufixul -ico de la sfârșitul numelui compusului organic..
Lanțul principal este cel care are legătura triplă și începe să fie numerotat de la capătul cel mai apropiat de acesta. Dacă aveți, de exemplu, ciclopropan, atunci având o legătură triplă se va numi ciclopropino (triunghiul din imagine). Dacă o grupare metil este atașată la vârful superior, atunci va fi: 2-metilciclopropino.
Carbonii R-C≡C-R au deja cele patru legături, deci îi lipsesc hidrogenii (așa cum este cazul tuturor cicloalcinelor din imagine). Acest lucru nu se întâmplă numai dacă legătura triplă se află într-o poziție terminală, adică la capătul unui lanț (R-C≡C-H).
Aplicații
Cicloalchinele nu sunt compuși foarte obișnuiți, deci nici aplicațiile lor. Ele pot servi ca lianți (grupuri care se coordonează) la metalele de tranziție, creând astfel o infinitate de compuși organometalici care pot fi utilizați pentru utilizări foarte riguroase și specifice..
În general, sunt solvenți în formele lor cele mai saturate și stabile. Când constau în heterocicluri, pe lângă faptul că au unități ciclice interne C≡C-C = C-C≡C, găsesc utilizări interesante și promițătoare ca medicamente anticanceroase; Acesta este cazul Dinemycin A. Alți compuși cu analogii structurale au fost sintetizați din aceasta..
Exemple
Imaginea prezintă șapte cicloalcine simple, în care există cu greu o legătură triplă. De la stânga la dreapta, cu numele lor respective sunt: ciclopropino, triunghiul; cyclobutino, pătratul; ciclopentină, pentagonul; ciclohexina, hexagonul; cicloheptina, heptagonul; ciclooctino, octogonul; și ciclodecino, decagonul.
Pe baza acestor structuri și înlocuind atomii de hidrogen ai carbonilor saturați, pot fi obținuți alți compuși derivați din acestea. Ele pot fi, de asemenea, supuse unor condiții oxidative pentru a genera legături duble pe alte părți ale ciclurilor..
Aceste unități geometrice pot face parte dintr-o structură mai mare, crescând șansele de funcționalizare a întregului set. Nu există multe exemple disponibile de cicloalchine, cel puțin nu fără a intra în tărâmurile profunde ale sintezei organice și farmacologiei..
Referințe
- Francis A. Carey. Chimie organica. (Ediția a șasea, Pp. 372, 375). Mc Graw Hill.
- Wikipedia. (2018). Cicloalchină. Luat de pe: en.wikipedia.org
- William Reusch. (5 mai 2013). Denumirea compușilor organici. Luat din: 2.chemistry.msu.edu
- Chimie anorganică. Cicloalchine. Luat de pe: fullquimica.com
- Patrizia Diana & Girolamo Cirrincione. (2015). Biosinteza heterociclurilor de la izolare la grupa de gene. Wiley, pagina 181.
- Chimie organică interesantă și produse naturale. (2015, 17 aprilie). Cicloalchini. Luat de pe: quintus.mickel.ch


Nimeni nu a comentat acest articol încă.