
Ciclopropan (C3H6) Structură, proprietăți, utilizări și riscuri

ciclopropan este o moleculă ciclică care are formula moleculară C3H6, și constând din trei atomi de carbon legați împreună sub forma unui inel. În chimie există o familie de hidrocarburi saturate care au un schelet format din atomi de carbon uniți prin legături simple sub forma unui inel..
Această familie este formată dintr-un număr variat de molecule (care diferă prin lungimea lanțului lor principal de carbon) și se știe că au puncte de topire și fierbere mai mari decât cele ale lanțurilor înalte, precum și o reactivitate mai mare decât acestea..
Ciclopropanul a fost descoperit în 1881 de către un chimist austriac numit August Freund, care era hotărât să știe care este elementul toxic din etilenă și care a ajuns să creadă că este același ciclopropan.
Chiar și așa, abia în anii 1930 a început să fie produs la nivel industrial, când au descoperit utilizările sale ca anestezie, deoarece înainte de acel moment nu au găsit atractivitate comercială.
Indice articol
- 1 Structura chimică
- 2 Proprietăți
- 2.1 Punctul de fierbere
- 2.2 Punctul de topire
- 2.3 Densitatea
- 2.4 Reactivitate
- 3 utilizări
- 4 Riscuri
- 5 Referințe
Structura chimică
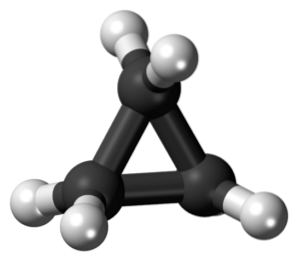
Ciclopropan, cu formula moleculară C3H6, Se compune din trei atomi de carbon mici care se unesc într-o configurație astfel încât se formează un inel, lăsând o simetrie moleculară a lui D.3h pe fiecare carbon din lanț.
Structura acestei molecule necesită ca unghiurile de legătură care se formează să fie de aproximativ 60º, mult mai mici decât cele 109,5º observate între atomii hibrizi sp.3, care este un unghi mai stabil termodinamic.
Acest lucru duce la inelul care suferă de o tensiune structurală mai semnificativă decât alte structuri de acest tip, pe lângă o tensiune naturală de torsiune pe care o posedă datorită conformației eclipsate a atomilor săi de hidrogen..
Din același motiv, legăturile care se formează între atomii de carbon din această moleculă sunt considerabil mai slabe decât în alcanii obișnuiți..
Într-un mod particular și spre deosebire de alte legături în care apropierea dintre două molecule simbolizează o energie de legătură mai mare, legăturile dintre carbonii acestei molecule au o particularitate de a avea o lungime mai mică decât ceilalți alcani (datorită geometriei lor) și în același timp ei sunt mai slabi decât uniunile dintre aceștia.
Mai mult, ciclopropanul posedă stabilitatea prin delocalizarea ciclică a celor șase electroni din legăturile carbon-carbon, fiind puțin mai instabil decât ciclobutanul și considerabil mai mult decât ciclohexanul..
Proprietăți
Punct de fierbere
În comparație cu ceilalți cicloalcani mai obișnuiți, ciclopropanul are cel mai scăzut punct de fierbere dintre aceste tipuri de molecule, voltatilizându-se la 33 de grade sub zero (niciun alt cicloalcan nu se volatilizează la temperaturi sub zero).
Pe de altă parte, în comparație cu propanul liniar, ciclopropanul are un punct de fierbere mai mare: se volatilizează la 42 ° C sub zero, ușor mai mic decât cel al vărului său de cicloalcan..
Punct de topire
Punctul de topire al ciclopropanului este mai mic decât cel al altor cicloalcani, topindu-se la o temperatură de 128 ° C mai mică decât zero. Chiar și așa, nu este singurul cicloalcan care se topește la o temperatură sub zero și acest fenomen poate fi observat și în ciclobutan, ciclopentan și cicloheptan..
Deci, în cazul propanului liniar, acesta se topește la o temperatură mai mică de 187 ° C sub zero..
Densitate
Ciclopropanul are cea mai mare densitate dintre cicloalcani, fiind de peste două ori mai mare decât cel mai dens cicloalcan comun (1,879 g / l pentru ciclopropan, depășind ciclodecanul cu 0,871).
O densitate mai mare este observată și în ciclopropan decât în propanul liniar. Diferența dintre punctele de fierbere și topire între alcani liniari și cicloalcani se datorează forțelor londoneze mai mari, care sunt crescute de forma inelului care permite o zonă de contact mai mare între atomii interni..
Reactivitate
Reactivitatea moleculei de ciclopropan este direct afectată de slăbiciunea legăturilor sale, crescând considerabil în comparație cu alți cicloalcani datorită efectului tensiunii exercitate asupra acestor legături..
Datorită acestui fapt, ciclopropanul poate fi separat mai ușor și se poate comporta ca o alchenă în anumite reacții. De fapt, reactivitatea extremă a amestecurilor ciclopropan-oxigen poate deveni un pericol de explozie..
Aplicații
Utilizarea comercială a ciclopropanului prin excelență este ca agent anestezic, studiind această proprietate pentru prima dată în 1929.
Ciclopropanul este un agent anestezic puternic, cu acțiune rapidă, care nu irită căile respiratorii sau are un miros urât. A fost folosit timp de câteva decenii împreună cu oxigenul pentru a adormi pacienții în timpul intervenției chirurgicale, dar au început să se observe efecte secundare nedorite, reprezentate ca „șoc ciclopropanic”..
Împreună cu costul și factorii de inflamabilitate ridicați, a trecut printr-un proces de eliminare și înlocuire cu alți agenți anestezici mai siguri..
Deși a continuat să facă parte din compușii utilizați în inducerea anesteziei, astăzi nu face parte din agenții utilizați în aplicații medicale.
Riscuri
- Ciclopropanul este un gaz foarte inflamabil, care produce gaze toxice atunci când intră în contact cu o flacără. În plus, poate reacționa cu agenți oxidanți precum perclorați, peroxizi, permanganați, nitrați și halogeni, provocând incendii și / sau explozii..
- Nivelurile ridicate de ciclopropan pot provoca dureri de cap, amețeli, greață, pierderea coordonării, senzație de leșin și / sau amețeală..
- De asemenea, poate duce la nereguli ale ritmului cardiac sau aritmie, dificultăți de respirație, comă și chiar moarte..
- Ciclopropanul lichefiat poate provoca degerături pe piele datorită temperaturii sale considerabil sub zero.
- Deoarece este un gaz în condiții ambientale, acest compus poate pătrunde cu ușurință în organism prin aer și, de asemenea, reduce nivelul de oxigen din aer..
Referințe
- Britannica, E. (s.f.). Ciclopropan. Adus de la britannica.com
- Chimie, O. (s.f.). Sinteza ciclopropanului. Recuperat de la organic-chemistry.org
- ChemSpider. (s.f.). Ciclopropan. Adus de pe chemspider.com
- Wagnières, O. (s.f.). Produse naturale care conțin ciclopropan. Recuperat de la lspn.epfl.ch
- Wikipedia. (s.f.). Ciclopropan. Adus de pe en.wikipedia.org



Nimeni nu a comentat acest articol încă.