
Structura chimică a acidului boric, proprietăți, preparat, utilizări
acid boric este un compus anorganic a cărui formulă chimică este H3BO3. Se compune dintr-un solid alb sau incolor. Este un acid slab care în soluție apoasă produce, în funcție de concentrația sa, un pH între 3,8 și 4,8. Este slab solubil în apă rece și moderat solubil în apă fierbinte..
Acidul boric a fost descoperit în 1702 de Wilhelm Homberg (1652-1713), care a tratat boraxul cu acid sulfuric, obținând o soluție cu acțiune medicinală care a primit numele de apa sedativă a lui Homberg..

Cu toate acestea, se subliniază, de asemenea, că Homberg a preparat acidul boric prin adăugarea de apă în borax și încălzirea soluției până la evaporarea acestuia, lăsând astfel cristalele de acid boric în sediment..
Acest acid este un compus foarte util, care are numeroase aplicații în industrie și medicină, fiind utilizat și ca insecticid, pentru conservarea lemnului, ignifug și este un component al unei soluții tampon de pH..
Indice articol
- 1 Structura chimică
- 1.1 Cristale
- 2 Proprietăți
- 2.1 Denumiri
- 2.2 Masa molară
- 2.3 Aspect fizic
- 2.4 Miros
- 2.5 Aromă
- 2.6 Punct de topire
- 2.7 Punctul de fierbere
- 2.8 Solubilitatea în apă
- 2.9 Solubilitate în alți solvenți
- 2.10 Coeficientul de partiție octanol / apă
- 2.11 Aciditate (pKa)
- 2.12 pH
- 2.13 Presiunea vaporilor
- 2.14 Stabilitate
- 2.15 Descompunerea
- 2.16 Reactivitate
- 3 Pregătirea
- 4 utilizări
- 4.1 În industrie
- 4.2 În medicină
- 4.3 Insecticid
- 4.4 Conservare
- Tampon de pH 4,5
- 4.6 Reactoare nucleare
- 4.7 Agricultură
- 5 Contraindicații
- 6 Referințe
Structura chimică
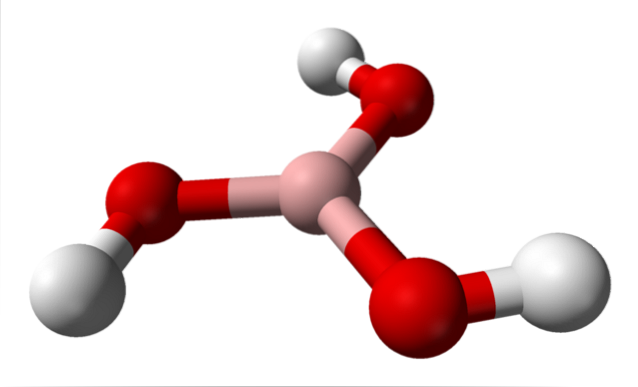
În imaginea superioară avem molecula însăși a lui H3BO3. Rețineți că atomii de hidrogen, reprezentați de sfere albe, nu sunt legați de atomul central de bor, așa cum ar putea sugera formula chimică; ci mai degrabă, la atomii de oxigen, reprezentați prin sfere roșii.
Astfel, o formulă mai convenabilă, deși mai puțin utilizată, pentru acidul boric este B (OH)3, indicând faptul că aciditatea sa se datorează ionilor H+ eliberate din grupurile lor OH. Molecula B (OH)3 are o geometrie plană trigonală, cu atomul său de bor având o hibridizare chimică spDouă.
B (OH)3 Este o moleculă foarte covalentă, deoarece diferența de electronegativitate între atomul de bor și oxigen nu este foarte mare; deci legăturile B-O sunt în esență covalente. De asemenea, rețineți că structura acestei molecule seamănă cu cea a unui filator. Se poate roti pe propria axă în același mod?
Cristale
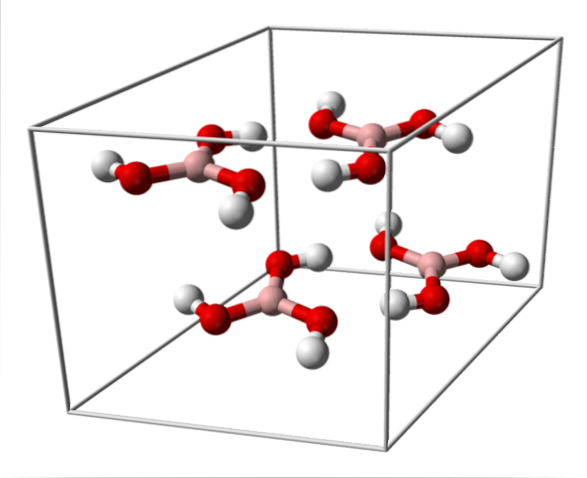
Imaginea superioară arată celula unitară corespunzătoare structurii cristaline triclinice pentru acidul boric care, în anumite condiții de sinteză, poate adopta structura hexagonală compactă. Rețineți că există patru molecule pe unitate de celulă și că sunt dispuse în două straturi, A și B, alternând (nu sunt suprapuse una peste alta).
Datorită simetriei și orientării legăturilor B-OH, se poate presupune că B (OH)3 este apolar; cu toate acestea, existența legăturilor de hidrogen intermoleculare schimbă povestea. Fiecare moleculă de B (OH)3 de a da sau primi trei dintre aceste punți, cu un total de șase interacțiuni dipol-dipol, așa cum se observă în imaginea de mai jos:
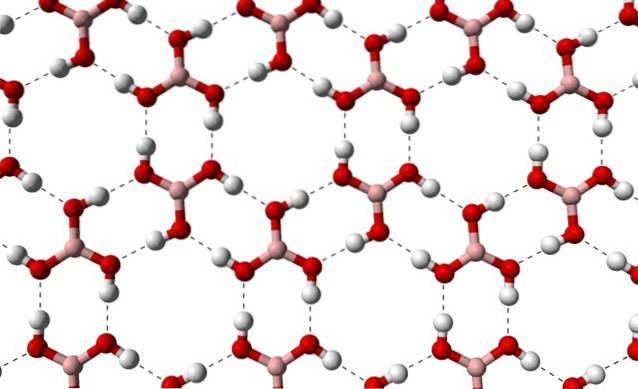
Rețineți că aceste legături de hidrogen sunt interacțiunile direcționale care guvernează cristalele de acid boric și stabilesc modele de aspecte ornamentale; inele interioare, probabil, cu suficient spațiu pentru a acoperi unele impurități care nu se află în defectele de cristal.
Aceste legături de hidrogen, în ciuda masei moleculare reduse a B (OH)3, își păstrează sticla suficient de coezivă încât să aibă nevoie de o temperatură de 171 ° C pentru a se topi. Nu se știe ce efecte ar avea presiunile mari (în ordinea GPa) asupra straturilor moleculare ale B (OH)3.
Proprietăți
Numele
IUPAC: acid boric și trihidroxid de bor. Alte denumiri: acid ortoboric, acid boracic, sassolit, borofax și trihidroxiburan.
Masă molară
61,83 g / mol
Aspectul fizic
Solid alb clar, incolor, cristalin. Este disponibil și sub formă de granule sau sub formă de pulbere albă. Ușor cremos la atingere.
Miros
Toaletă
Gust
Puțin amar
Punct de topire
170,9 ºC
Punct de fierbere
300 ºC
Solubilitatea apei
Solubil moderat în apă rece și solubil în apă fierbinte:
2,52 g / 100 ml (0 ºC)
27,50 g / 100 ml (100 ºC)
Acidul boric este parțial solubil în apă și tinde să se scufunde în el. Această solubilitate tinde să crească în prezența acizilor, cum ar fi clorhidric, citric și tartric..
Solubilitate în alți solvenți
-Glicerol: 17,5% la 25 ° C
-Etilenglicol: 18,5% la 25 ° C
-Acetonă: 0,6% la 25 ° C
-Acetat de etil: 1,5% la 25 ° C
-Metanol: 172 g / L la 25 ° C
-Etanol: 94,4 g / L la 25 ° C
Coeficientul de partiție octanol / apă
Jurnal P = -0,29
Aciditate (pKa)
9.24. 12.4. 13.3. Acestea sunt cele trei constante ale disociațiilor lor respective pentru a elibera H+ in apa.
pH
3,8 - 4,8 (3,3% în soluție apoasă)
5,1 (0,1 molari)
Presiunea de vapori
1.6 10-6 mmHg
Stabilitate
Stabil în apă
Descompunere
Se descompune atunci când este încălzit la peste 100 ° C, formând anhidridă borică și apă.
Reactivitate
Acidul boric formează săruri solubile cu cationi monovalenți, de exemplu: NaDouăB4SAU7.10HDouăO și săruri insolubile cu cationi divalenți, CaB4SAU7.6HDouăSAU.
În soluție apoasă produce o soluție acidă, crezând că această proprietate se datorează scăderii grupărilor OH- a apei. Acidul boric este clasificat ca un acid slab de tip Lewis.
Acidul boric reacționează cu glicerol și manitol, crescând aciditatea mediului apos. PKa este modificat de la 9,2 la 5, datorită formării chelatului de bor-manitol [BC6H8SAUDouă(OH)Două]-, care eliberează H+.
Pregătirea
Acidul boric se găsește în stare liberă în emanații vulcanice în regiuni precum Toscana în Italia, Insulele Lipari și în statul Nevada, SUA. Se găsește și în minerale precum borax, boracit, ulexit și colemanit..
Acidul boric este preparat în principal prin reacția boraxului mineral (tetraborat de sodiu decahidrat) cu acizi minerali, cum ar fi acidul clorhidric, acidul sulfuric etc..
N / ADouăB4SAU910HDouăO + HCI => 4 H3BO3 + 2 NaCI + 5HDouăSAU
De asemenea, se prepară prin hidroliza trihalurii de bor și a diboranului..
Acidul boric este preparat din colemanit (CaDouăB6SAUunsprezece6 HDouăSAU). Procedura constă în tratarea mineralului cu acid sulfuric pentru a dizolva compușii de bor.
Apoi, soluția în care este prezent acidul boric este separată de fragmentele nedizolvate. Soluția este tratată cu hidrogen sulfurat pentru a precipita impuritățile de arsen și fier. Supernatantul este răcit pentru a produce un precipitat de acid boric și îl separă de suspensie..
Aplicații
În industrie
Acidul boric este utilizat la fabricarea fibrelor de sticlă. Ajutând la reducerea punctului de topire, crește rezistența și eficiența fibrei de sticlă textile: un material folosit pentru a consolida plasticul utilizat în nave, țevi industriale și plăci de circuite pentru calculatoare..
Acidul boric participă la fabricarea sticlei borosilicate, care permite obținerea unei sticle rezistente la schimbările de temperatură, utilizabilă în bucătăria caselor, în sticlărie în laboratoare, tuburi fluorescente, fibre optice, ecrane LCD etc..
Este utilizat în industria metalurgică pentru întărirea și tratarea aliajelor de oțel, precum și pentru promovarea acoperirii metalice a materialelor.
Este utilizat ca component chimic în fracturarea hidraulică (fracking): o metodă utilizată în extracția de petrol și gaze. Acidul boric acționează ca un ignifug în celuloza, materialele plastice și textile care sunt impregnate cu acid boric pentru a-și crește rezistența la foc..
În medicină
Acidul boric se utilizează diluat la spălarea ochilor. Capsulele de gelatină cu acid boric sunt utilizate pentru a trata infecțiile fungice, în special Candida albicans. De asemenea, a fost utilizat în tratamentul acneei.
Acidul boric este presărat pe șosete pentru a preveni infecțiile piciorului, cum ar fi piciorul de atlet. De asemenea, soluțiile care conțin acid boric sunt utilizate în tratamentul otitei externe la om, precum și la animale..
Acidul boric este adăugat la sticlele utilizate pentru colectarea urinei, ceea ce previne contaminarea bacteriană înainte de a fi examinat în laboratoarele de diagnosticare..
Insecticid
Acidul boric este utilizat pentru a controla proliferarea insectelor, cum ar fi gândacii, termitele, furnicile etc. Nu ucide instantaneu gândacii, deoarece le afectează mai întâi sistemul digestiv și nervos, pe lângă distrugerea exoscheletului.
Acidul boric își exercită acțiunea lent, permițând insectelor care l-au ingerat să intre în contact cu alte insecte, răspândind astfel otrăvirea..
Conservare
Acidul boric este utilizat pentru a preveni atacul lemnului de către ciuperci și insecte, fiind utilizat în acest scop împreună cu etilenglicolul. Acest tratament este, de asemenea, eficient în combaterea nămolului și a algelor..
Tampon PH
Acidul boric și baza sa conjugată formează un sistem tampon de pKa = 9,24, ceea ce indică faptul că acest tampon este cel mai eficient la pH alcalin, ceea ce nu este obișnuit la ființele vii. Cu toate acestea, tamponul de borat este utilizat în reglarea pH-ului în piscine..
Reactoare nucleare
Acidul boric are capacitatea de a captura neutroni termici, ceea ce reduce posibilitatea unei fisiuni nucleare necontrolate care poate duce la accidente nucleare..
agricultură
Borul este un element esențial pentru creșterea plantelor, ceea ce a dus la utilizarea acidului boric pentru contribuția elementului. Cu toate acestea, prea mult acid boric poate dăuna plantelor, în special citricelor..
Contraindicații
Trebuie evitată utilizarea acidului boric pe pielea denudată, pe produsul rănit sau ars, care permite absorbția acestuia. Acesta este un compus toxic în interiorul corpului și, în unele cazuri, poate provoca leșin, convulsii, spasme, ticuri faciale și tensiune arterială scăzută..
Medicul trebuie consultat pentru utilizarea capsulelor vaginale de acid boric la femeile gravide, deoarece s-a indicat că ar putea provoca deformări fetale și o scădere a greutății corporale a copilului la naștere..
De asemenea, trebuie evitată plasarea acidului boric, utilizat ca insecticid, în locuri la îndemâna copiilor, deoarece copiii au o susceptibilitate mai mare la acțiunea toxică a acidului boric, stabilind doza fatală la aceștia de la 2.000 la 3.000 mg.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Acid boric. Recuperat de pe: en.wikipedia.org
- Centrul Național pentru Informații despre Biotehnologie. (2019). Acid boric. Baza de date PubChem. CID = 7628. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Editorii Enciclopediei Britanice. (28 martie 2019). Acid boric. Encyclopædia Britannica. Recuperat de pe: britannica.com
- Carrier Vibrating. (9 noiembrie 2018). Utilizările ascunse ale acidului boric în viața ta de zi cu zi. Recuperat de pe: carriervibrating.com
- Centrul Național de Informare asupra Pesticidelor. (s.f.). Acid boric. Recuperat de la: npic.orst.edu
- Redactare. (30 noiembrie 2017). Acid boric: proprietăți și utilizări ale acestui compus chimic. Recuperat de pe: acidos.info
- Clorură de sodiu. (2019). Acid boric. Recuperat de pe: chlorurosodio.com
- Societatea spaniolă de farmacie spitalicească. (s.f.). Acid boric. [PDF]. Recuperat de la: workgroups.sefh.es



Nimeni nu a comentat acest articol încă.