
Structura, proprietățile și utilizările acidului clorhidric (HCl)

acid clorhidric (HCI) sau acidul muriatic este un compus anorganic care se formează prin dizolvarea în apă a clorurii de hidrogen, originând ionul hidroniu (H3SAU+) și ionul clorură (Cl-). Mai precis, este hidracidul clorului halogen cu hidrogenul.
HCl este un acid puternic care ionizează complet în apă și produsele sale de ionizare sunt stabile. Ionizarea completă a HCI este coroborată de faptul că pH-ul unei soluții de HCI 0,1 M este 1.

Principala metodă pentru producția industrială de HCI este clorurarea compușilor organici pentru a produce, de exemplu, diclormetan, tricloretilenă, percloretilenă sau clorură de vinil. HCI este un produs secundar al reacției de clorurare.
Se folosește la titrarea bazelor în numeroase reacții chimice, la digestia chimică a compușilor organici etc..
Fumurile de acid clorhidric (clorură de hidrogen) pot răni grav ochii. În plus, pot provoca iritații și probleme grave la nivelul căilor respiratorii.
Lumenul gastric are un pH acid (1-3) cu o concentrație mare de HCI. Prezența acidă favorizează sterilizarea conținutului gastric, inactivând numeroase bacterii prezente în aliment. Acest lucru ar explica gastroenterita asociată cu starea aclorhidriei.
În plus, HCl facilitează digestia proteinelor prin activarea enzimei proteolitice pepsină..
Se utilizează la curățarea piscinelor, de obicei este suficient un detergent obișnuit, dar există pete care aderă între plăci, necesitând în aceste cazuri utilizarea acidului clorhidric.
Este utilizat în controlul pH-ului în produse farmaceutice, alimente și apă potabilă. Este, de asemenea, utilizat în neutralizarea fluxurilor de deșeuri care conțin material alcalin..
Acidul clorhidric este utilizat în regenerarea rășinilor schimbătoare de ioni, utilizat pentru sechestrarea ionilor metalici sau a altor tipuri de ioni din industrie, în laboratoarele de cercetare și în purificarea apei potabile..
Pe de altă parte, se poate comenta și faptul că clorura de hidrogen, un compus gazos, este o moleculă diatomică și atomii care o formează sunt uniți printr-o legătură covalentă. Între timp, acidul clorhidric este un compus ionic care în soluție apoasă se disociază în H+ și Cl-. Interacțiunea dintre acești ioni este electrostatică..
Indice articol
- 1 Structura chimică
- 2 Instruire
- 3 Unde se află?
- 3.1 Gastrin
- 3.2 Histamina
- 3.3 Acetilcolina
- 3.4 Alte surse de HCl biologic
- 4 Proprietăți fizice și chimice
- 4.1 Greutate moleculară
- 4.2 Culoare
- 4.3 Miros
- 4.4 Aromă
- 4.5 Punctul de fierbere
- 4.6 Punct de topire
- 4.7 Solubilitate în apă
- 4.8 Solubilitatea în metanol
- 4.9 Solubilitate în etanol
- 4.10 Solubilitate în eter
- 4.11 Densitate
- 4.12 Densitatea gazului
- 4.13 Densitatea vaporilor
- 4.14 Presiunea vaporilor
- 4.15 Stabilitate
- 4.16 Autoinflamare
- 4.17 Descompunerea
- 4.18 Corozivitate
- 4.19 Tensiunea superficială
- 4.20 Polimerizare
- 5 utilizări
- 5.1 Industrial și casnic
- 5.2 Sinteza și reacțiile chimice
- 6 Riscuri și toxicitate
- 7 Prevenirea deteriorării acidului clorhidric
- 8 Referințe
Structura chimică
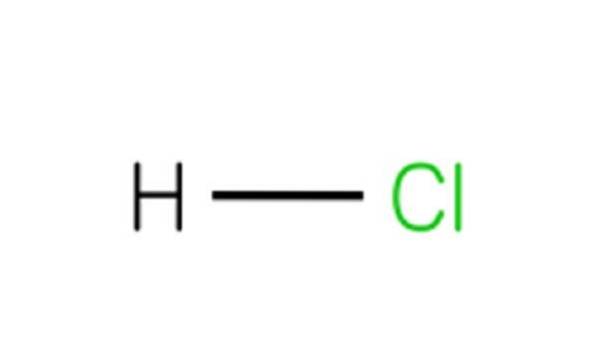
Fiecare moleculă de HCl este alcătuită dintr-un atom de hidrogen și un atom de clor. Deși la temperatura camerei HCI este otrăvitor și este un gaz incolor, dacă se dizolvă în apă, dă acid clorhidric..
Instruire

-Poate fi produs prin electroliza NaCl (clorură de sodiu) care provine de la HDouă (g), ClDouă (g), 2Na (ac) și OH- (ac). Mai tarziu:
HDouă + ClDouă => 2 HCI
Aceasta este o reacție exotermă.
-HCI este produs prin reacția clorurii de sodiu cu acidul sulfuric. Proces care poate fi conturat în felul următor:
NaCI + HDouăSW4 => NaHSO4 + acid clorhidric
Apoi, clorura de hidrogen este colectată și clorura de sodiu este reacționată cu bisulfitul de sodiu conform următoarei reacții:
NaCI + NaHSO4 => NaDouăSW4 + acid clorhidric
Această reacție a fost introdusă de Johan Glauber în secolul al XVII-lea pentru a produce acid clorhidric. În prezent, este utilizat în principal în laboratoare, deoarece importanța utilizării sale industriale a scăzut.
-Acidul clorhidric poate fi produs ca un produs secundar al clorării compușilor organici, de exemplu: în producția de diclormetan.
CDouăH4 + ClDouă => CDouăH4ClDouă
CDouăH4ClDouă => CDouăH3Cl + HCI
Această metodă de producere a HCl este mai utilizată industrial, calculându-se că 90% din HCl produs în Statele Unite este prin această metodologie.
-Și, în cele din urmă, HCl este produs în incinerarea deșeurilor organice clorurate:
C4H6ClDouă + 5 ODouă => 4 CODouă + 2 oreDouăO + 2 HCI
Unde se află?
Acidul clorhidric este concentrat în lumenul gastric unde se atinge un pH de 1. Existența unei bariere a mucusului, bogată în bicarbonat, împiedică celulele gastrice să sufere daune din cauza pH-ului gastric scăzut..
Există trei stimuli fiziologici principali pentru secreția de H+ de către celulele parietale ale corpului gastric: gastrină, histamină și acetilcolină.
Gastrin
Gastrina este un hormon secretat în regiunea antrului gastric care acționează prin creșterea concentrației intracelulare de Ca, intermediar în activarea transportului activ de H+ spre lumenul gastric.
Transportul activ este realizat de o enzimă ATPază care folosește energia conținută în ATP pentru a transporta H+ spre lumenul gastric și introduceți K+.
Histamina
Este secretat de așa-numitele celule asemănătoare enterocromafinei (SEC) ale corpului gastric. Acțiunea sa este mediată de o creștere a concentrației de AMP ciclic și acționează prin creșterea, la fel ca gastrina, a transportului activ al H+ spre lumenul gastric mediat de o pompă H+-K+.
Acetilcolina
Este secretată de terminalele nervoase vagale, la fel cum gastrina își mediază acțiunea printr-o creștere a Ca intracelular, activând acțiunea pompei H.+-K+.
H+ a celulelor parietale provine din reacția CODouă cu HDouăO pentru a forma HDouăCO3 (acid carbonic). Aceasta se descompune ulterior în H+ și HCO3-. H+ este transportat activ în lumenul gastric prin membrana apicală gastrică. Între timp, HCO3- este adus în sânge cuplat la intrarea Cl-.
Mecanismul de contra-transport sau antitransport Cl-HCO3- care apare în membrana bazală a celulelor parietale produce acumularea intracelulară de Cl-. Ulterior, ionul trece în lumenul gastric însoțind H+. Se estimează că secreția gastrică de HCI are o concentrație de 0,15 M.
Alte surse de HCl biologic
Există și alți stimuli pentru secreția de HCl de către celulele parietale, cum ar fi cofeina și alcoolul.
Ulcerele gastrice și duodenale apar atunci când bariera care protejează celulele gastrice de acțiunea dăunătoare a HCl este perturbată..
Prin eliminarea acțiunii protectoare menționate anterior, bacteriile Helicobacter pylori, acidul acetilsalicilic și medicamentele antiinflamatoare nesteroidiene (AINS) contribuie la producerea ulcerelor..
Secreția acidă are funcția de a elimina microbii prezenți în alimente și de a iniția digestia proteinelor, prin acțiunea pepsinei. Principalele celule ale corpului gastric secretă pepsinogen, o proenzimă care este transformată în pepsină de pH-ul scăzut al lumenului gastric.
Proprietati fizice si chimice
Greutate moleculară
36,458 g / mol.
Culoare
Este un lichid incolor sau ușor gălbui.
Miros
Este un miros acrit iritant.
Gust
Pragul pentru degustare este că apa pură are o concentrație de 1,3 x 10-4 alunițe / l.
Punct de fierbere
-121º F la 760 mmHg. -85,05º C la 760 mmHg.
Punct de topire
-174º F (-13.7º F) pentru o soluție de HCI 39,7% g / g în apă), -114,22º C.
Solubilitatea apei
Soluția de HCI poate fi de 67% g / g la 86 ° F; 82,3 g / 100 g apă la 0 ° C; 67,3 g / 100 g apă la 30 ° C și 63,3 g / 100 g apă la 40 ° C.
Solubilitate în metanol
51,3 g / 100 g de soluție la 0 ° C și 47 g / 100 de soluție la 20 ° C
Solubilitate în etanol
41,0 / 100 g de soluție la 20 ° C
Solubilitate în eter
24,9 g / 100 de soluție la 20 ° C.
Densitate
1,059 g / ml la 59 ° F într-o soluție de 10,17% g / g.
Densitatea gazului
1.00045 g / L
Densitatea vaporilor
1.268 (în raport cu aerul luat ca 1)
Presiunea de vapori
32.452 mmHg la 70 ° F; 760 mmHg la -120,6º F
Stabilitate
Are o stabilitate termică ridicată.
Auto-aprindere
Nu este inflamabil.
Descompunere
Se descompune la încălzire emițând fum toxic de clor.
Vâscozitate: 0,405 cPoise (lichid la 118,6 º K), 0,0131 cPoise (vapori la 273,06 º K).
Corozivitate
Este foarte coroziv pentru aluminiu, cupru și oțel inoxidabil. Atacă toate metalele (mercur, aur, platină, argint, tantal, cu excepția anumitor aliaje).
Tensiune de suprafata
23 mN / cm la 118,6º K.
Polimerizare
Aldehidele și epoxizii suferă o polimerizare violentă în prezența acidului clorhidric.
Proprietățile fizice, cum ar fi vâscozitatea, presiunea vaporilor, punctul de fierbere și punctul de topire sunt influențate de concentrația procentuală g / g de HCI.
Aplicații
Acidul clorhidric are multe utilizări acasă, în diferite industrii, în laboratoare de predare și cercetare etc..
Industrial și casnic
-Acidul clorhidric este utilizat în procesarea hidrometalurgică, de exemplu în producția de alumină și dioxid de titan. Este utilizat în activarea producției de puțuri de petrol.
Injecția acidului mărește porozitatea din jurul uleiului, favorizând astfel extracția acestuia..
-Este utilizat pentru îndepărtarea depozitelor de CaCO3 (carbonat de calciu) prin transformarea sa în CaClDouă (clorură de calciu) care este mai solubilă și mai ușor de îndepărtat. De asemenea, este utilizat industrial în prelucrarea oțelului, un material cu multe utilizări și aplicații, atât în industrie, în construcții, cât și în casă..
-Masonii folosesc soluții de HCl pentru a spăla și curăța cărămizile. Se folosește în casă pentru curățarea și dezinfectarea băilor și a canalelor de scurgere a acestora. În plus, acidul clorhidric este utilizat în gravuri, inclusiv în operațiile de curățare a metalelor..
-Acidul clorhidric are aplicare în eliminarea stratului de oxid de fier mucegai care se acumulează pe oțel, înainte de prelucrarea ulterioară în extrudare, laminare, galvanizare etc..
CredinţăDouăSAU3 + Fe + 6 HCI => 3 FeClDouă + HDouăSAU
-În ciuda faptului că este extrem de coroziv, este utilizat pentru îndepărtarea petelor de metal prezente în fier, cupru și alamă, utilizând o diluție 1:10 în apă..
Sinteza și reacțiile chimice
-Acidul clorhidric este utilizat în reacțiile de titrare pentru baze sau alcali, precum și în ajustarea pH-ului soluțiilor. În plus, este utilizat în numeroase reacții chimice, de exemplu în digestia proteinelor, o procedură anterioară studiilor privind conținutul de aminoacizi și identificarea acestora..
-O utilizare principală a acidului clorhidric este producerea de compuși organici, cum ar fi clorura de vinil și diclormetan. Acidul este un intermediar în producția de policarbonați, cărbune activ și acid ascorbic.
-Se utilizează la fabricarea lipiciului. În timp ce în industria textilă este utilizat în albirea țesăturilor. Se utilizează în industria bronzării pielii, intervenind în prelucrarea acesteia. De asemenea, se folosește ca îngrășământ și în producția de clorură, coloranți etc. Este, de asemenea, utilizat în galvanizare, fotografie și industria cauciucului..
-Se folosește la producerea mătasei artificiale, la rafinarea uleiurilor, grăsimilor și săpunurilor. În plus, este utilizat în reacții de polimerizare, izomerizare și alchilare..
Riscuri și toxicitate
Are o acțiune corozivă asupra pielii și a mucoaselor, provocând arsuri. Acestea, dacă sunt severe, pot provoca ulcerații, lăsând cicatrici cheloide și retractile. Contactul cu ochii poate determina reducerea sau pierderea totală a vederii din cauza deteriorării corneei..
Când acidul ajunge la față, poate provoca cicluri grave care desfigurează fața. Contactul frecvent cu acidul poate provoca și dermatită..
Ingerarea acidului clorhidric arde gura, gâtul, esofagul și tractul gastro-intestinal, provocând greață, vărsături și diaree. În cazuri extreme, poate apărea perforarea esofagului și a intestinului, cu stop cardiac și deces..
Pe de altă parte, vaporii acizi, în funcție de concentrația lor, pot provoca iritații ale căilor respiratorii, provocând faringită, edem al glotei, îngustarea bronhiilor cu bronșită, cianoză și edem pulmonar (acumularea excesivă de lichid în plămâni) și în cazuri extreme, moartea.
Expunerea la niveluri ridicate de vapori acizi poate provoca umflarea gâtului și spasm cu consecința sufocării..
Frecvente sunt și necroze dentare care apar în dinți odată cu pierderea strălucirii; devin gălbui și înfundat, în cele din urmă rupt.
Prevenirea deteriorării acidului clorhidric
Există un set de reguli pentru siguranța persoanelor care lucrează cu acid clorhidric:
-Persoanele cu antecedente de boli respiratorii și digestive nu ar trebui să lucreze în medii cu prezență de acid..
-Lucrătorii trebuie să poarte îmbrăcăminte rezistentă la acid, chiar și cu glugă; ochelari de protecție a ochilor, protecții pentru brațe, mănuși rezistente la acid și pantofi cu aceleași caracteristici. De asemenea, ar trebui să poarte măști de gaze și, în caz de expunere severă la vapori de acid clorhidric, se recomandă utilizarea aparatului de respirație autonom..
-Mediul de lucru trebuie să aibă și dușuri de urgență și fântâni pentru spălarea ochilor..
-În plus, există standarde pentru mediile de lucru, precum tipul de podea, circuitele închise, protecția echipamentelor electrice etc..
Referințe
- StudiousGuy. (2018). Acid clorhidric (HCl): utilizări și aplicații importante. Luat de pe: studiousguy.com
- Ganong, W. F. (2003). Revizuirea fiziologiei medicale. A douăzeci și una de ediții. Companiile McGraw-Hill INC.
- PubChem. (2018). Acid clorhidric. Luat de la: pubchem.ncbi.nlm.nih.gov
- Weebly. Acid clorhidric. Preluat de pe: psa-hydrochloric-acid.weebly.com
- CTR. Fișa tehnică de securitate a acidului clorhidric. [PDF]. Luat de la: uacj.mx


Nimeni nu a comentat acest articol încă.