
Structura acidului cromic, proprietăți, producție, utilizări

acid cromic sau HDouăCrO4 este teoretic acidul asociat cu oxidul de crom (VI) sau oxidul crom CrO3. Acest nume se datorează faptului că specia HDouăCrO4 este prezent alături de alte specii de crom (VI).
Oxid cromic CrO3 se mai numește acid cromic anhidru. CrO3 este un solid maroniu-roșcat sau violet care se obține prin tratarea soluțiilor de dicromat de potasiu KDouăCrDouăSAU7 cu acid sulfuric HDouăSW4.

Soluțiile apoase de oxid crom experimentează un echilibru al anumitor specii chimice a căror concentrație depinde de pH-ul soluției. La pH bazic predomină ionii cromatici CrO4Două-, în timp ce la pH acid predomină ionii HCrO4- și dicromat CrDouăSAU7Două-. Se estimează că la pH acid este prezent și acidul cromic HDouăCrO4.
Datorită puterii lor mari de oxidare, soluțiile de acid cromic sunt utilizate în chimia organică pentru a efectua reacții de oxidare. Ele sunt, de asemenea, utilizate în procesele electrochimice pentru tratarea metalelor într-un mod care le face rezistente la coroziune și uzură..
Anumite materiale polimerice sunt, de asemenea, tratate cu acid crom pentru a-și îmbunătăți aderența la metale, vopsele și alte substanțe..
Soluțiile de acid crom sunt extrem de periculoase pentru oameni, pentru majoritatea animalelor și pentru mediu. Din acest motiv, deșeurile lichide sau solide din procesele în care se utilizează acidul crom sunt tratate pentru a elimina urmele de crom (VI) sau pentru a recupera tot cromul prezent și a regenera acidul crom pentru reutilizare..
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Densitatea
- 3.5 Solubilitate
- 3.6 Alte proprietăți
- 4 Chimia soluțiilor apoase în care este prezent acid cromic
- 5 Obținerea
- 6 Utilizări ale acidului cromic
- 6.1 În oxidarea compușilor chimici
- 6.2 În procesele de anodizare a metalelor
- 6.3 În tratamentele de conversie chimică
- 6.4 Pe suprafețe erodate sau cu sâmburi
- 6.5 În diverse utilizări
- 7 Recuperarea acidului cromic
- 7.1 Prin utilizarea rășinilor
- 7.2 Prin regenerare electrochimică
- 8 Utilizarea microorganismelor pentru curățarea efluenților cu urme de acid crom
- 9 Riscuri de acid crom și oxid de crom
- 10 Referințe
Structura
Molecula de acid cromic HDouăCrO4 este format dintr-un ion cromat CrO4Două- și doi ioni de hidrogen H+ atașat de aceasta. În ionul cromat elementul Crom se află într-o stare de oxidare de +6.
Structura spațială a ionului cromat este tetraedrică, unde cromul este în centru și oxigenii ocupă cele patru vârfuri ale tetraedrului..
În acidul crom, atomii de hidrogen sunt fiecare împreună cu un oxigen. Dintre cele patru legături ale cromului cu atomii de oxigen, două sunt duble și două sunt simple, deoarece au hidrogenii atașați la ele.
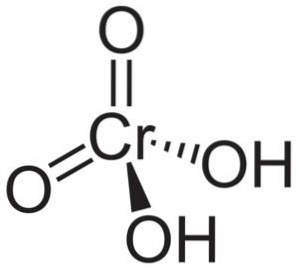
Pe de altă parte, oxidul crom CrO3 are un atom de crom în starea de oxidare +6 înconjurat de doar trei atomi de oxigen.
Nomenclatură
- Acid cromic HDouăCrO4
- Acid tetraoxocromic HDouăCrO4
- Oxid cromic (acid cromic anhidru) CrO3
- Trioxid de crom (acid cromic anhidru) CrO3
Proprietăți
Starea fizică
Acidul crom anhidru sau oxidul cromic sunt un solid cristal purpuriu până la roșu
Greutate moleculară
CrO3: 118,01 g / mol
Punct de topire
CrO3: 196 ºC
Peste punctul de topire este instabil termic, pierde oxigen (se reduce) pentru a da oxid de crom (III) CrDouăSAU3. Se descompune la aproximativ 250 ° C.
Densitate
CrO3: 1,67-2,82 g / cm3
Solubilitate
CrO3 este foarte solubil în apă: 169 g / 100 g apă la 25 ° C.
Este solubil în acizi minerali precum sulfuric și azotic. Solubil în alcool.
Alte proprietăți
CrO3 este foarte higroscopic, cristalele sale sunt deliquescente.
Când CrO3 se dizolvă în apă formează soluții puternic acide.
Este un oxidant foarte puternic. Oxidează energic materia organică în aproape toate formele sale. Atacă țesătura, pielea și unele materiale plastice. Atacă, de asemenea, majoritatea metalelor.
Este puternic otrăvitor și foarte iritant datorită potențialului său ridicat de oxidare..
Chimia soluțiilor apoase în care este prezent acid cromic
Oxid cromic CrO3 se dizolvă rapid în apă. În soluție apoasă, cromul (VI) poate exista sub diferite forme ionice.
La pH> 6,5 sau în soluție alcalină, cromul (VI) capătă forma ionului cromat CrO4Două- galben.
Dacă pH-ul este redus (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , care se poate dimeriza la ion dicromat CrDouăSAU7Două-, iar soluția devine portocalie. La pH între 2,5 și 5,5 speciile predominante sunt HCrO4- și CRDouăSAU7Două-.

Soldurile care apar în aceste soluții pe măsură ce scade pH-ul sunt următoarele:
CrO4Două- (ion cromat) + H+ ⇔ HCrO4-
HCrO4- + H+ ⇔ HDouăCrO4 (acid crom)
2HCrO4- ⇔ CrDouăSAU7Două- (ion dicromat) + HDouăSAU
Aceste echilibre apar numai dacă acidul adăugat pentru scăderea pH-ului este HNO3 sau HClO4, deoarece cu alți acizi se formează diferiți compuși.
Soluțiile de dicromat acid sunt agenți oxidanți foarte puternici. Dar în soluțiile alcaline ionul cromat este mult mai puțin oxidant.
Obținerea
Potrivit surselor consultate, una dintre modalitățile de obținere a oxidului de crom CrO3, Aceasta constă în adăugarea acidului sulfuric la o soluție apoasă de dicromat de sodiu sau potasiu, formând un precipitat roșu-portocaliu..

Acid cromic HDouăCrO4 Se găsește în soluții apoase de oxid crom într-un mediu acid.
Utilizările acidului cromic
În oxidarea compușilor chimici
Datorită capacității sale puternic oxidante, acidul crom a fost folosit cu mult timp cu succes pentru oxidarea compușilor organici și anorganici..
Printre nenumărate exemple se numără următoarele: permite oxidarea alcoolilor primari în aldehide și aceștia în acizi carboxilici, alcooli secundari în cetone, toluen în acid benzoic, etilbenzen în acetofenonă, trifenilmetan în trifenilcarbinol, acid formic în CODouă, acid oxalic la CODouă, acid lactic la acetaldehidă și CODouă, ion feros FeDouă+ la ionul feric Fe3+, ion de iod la iod, etc.
Permite conversia nitro-compușilor în nitro-compuși, sulfuri în sulfone. Este implicat în sinteza cetonelor pornind de la alchene, deoarece oxidează alchenele hidroborate la cetone.
Compuși foarte rezistenți la oxidanții obișnuiți, cum ar fi oxigenul ODouă sau peroxid de hidrogen HDouăSAUDouă, sunt oxidate de acidul cromic. Acesta este cazul anumitor borani heterociclici.
În procesele de anodizare a metalelor
Anodizarea acidului cromic este un tratament electrochimic aplicat aluminiului pentru a-l proteja mulți ani de oxidare, coroziune și uzură..
Procesul de anodizare implică formarea electrochimică a unui strat de oxid de aluminiu sau alumină pe metal. Acest strat este apoi sigilat în apă fierbinte, cu care se realizează conversia în trihidrat de oxid de aluminiu..
Stratul de oxid etanș este gros, dar din punct de vedere structural slab și nu este foarte satisfăcător pentru lipirea ulterioară. Cu toate acestea, adăugarea unei cantități mici de acid cromic în apa de etanșare dezvoltă o suprafață care poate forma legături bune..
Acidul cromic din apa de etanșare dizolvă o parte a structurii asemănătoare celulelor și lasă un strat subțire, puternic, ferm atașat de oxid de aluminiu, la care aderenții aderă și formează legături puternice și durabile..
Anodizarea acidului cromic se aplică și titanului și aliajelor sale.
În tratamentele de conversie chimică
Acidul cromic este utilizat în procesele de acoperire a metalelor prin conversie chimică.
În timpul acestui proces, metalele sunt scufundate în soluții de acid cromic. Aceasta reacționează și dizolvă parțial suprafața în timp ce depune un strat subțire de compuși complexi de crom care interacționează cu metalul de bază..
Acest proces se numește acoperire de conversie cromată sau placare cromată de conversie..
Metalele care sunt în general supuse cromării de conversie sunt diferite tipuri de oțel, cum ar fi oțelul carbon, oțelul inoxidabil și oțelul zincat și diverse metale neferoase, cum ar fi aliajele de magneziu, aliajele de staniu, aliajele de aluminiu, cuprul. , cadmiu, mangan și argint.
Acest tratament oferă rezistență la coroziune și strălucire metalului. Cu cât pH-ul procesului este mai mare, cu atât este mai mare rezistența la coroziune. Temperatura accelerează reacția acidă.
Se pot aplica acoperiri de diferite culori, cum ar fi albastru, negru, auriu, galben și clar. De asemenea, asigură o mai bună aderență a suprafeței metalice la vopsele și adezivi.
În suprafețele erodate sau cu gropi
Soluțiile de acid cromic sunt utilizate la prepararea suprafeței obiectelor din material termoplastic, polimeri termorezistenți și elastomeri pentru acoperirea lor ulterioară cu vopsele sau adezivi..
HDouăCrO4 are un efect asupra chimiei suprafeței și a structurii sale, deoarece ajută la creșterea rugozității sale. Combinația de scobire și oxidare crește penetrarea adezivilor și poate provoca chiar modificări ale proprietăților polimerului..
A fost utilizat pentru erodarea polietilenei ramificate de joasă densitate, a polietilenei liniare de înaltă densitate și a polipropilenei.
Este utilizat pe scară largă în industria de galvanizare sau galvanizare pentru a facilita aderența metal-polimer.
În diverse utilizări
Acidul cromic este utilizat ca conservant pentru lemn, de asemenea în materiale magnetice și pentru cataliza reacțiilor chimice.
Recuperarea acidului cromic
Există multe procese care utilizează acid crom și generează fluxuri sau reziduuri care conțin crom (III) care nu pot fi eliminate deoarece au ioni de crom (VI) foarte toxici și nici nu pot fi refolosite deoarece concentrația de ioni cromat este foarte mare scăzut..
Eliminarea lor necesită reducerea chimică a cromatilor la crom (III), urmată de precipitarea hidroxidului și filtrare, ceea ce generează costuri suplimentare.
Din acest motiv, au fost studiate diferite metode pentru îndepărtarea și recuperarea cromatului. Iată câteva dintre acestea.
Prin utilizarea rășinilor
Rășinile schimbătoare de ioni au fost folosite de mulți ani pentru tratarea apei contaminate cu cromați. Acesta este unul dintre tratamentele aprobate de Agenția SUA pentru Protecția Mediului sau EPA. agenție de protecție a mediului).
Această metodă permite recuperarea acidului cromic concentrat, deoarece este regenerat din nou din rășină..
Rășinile pot fi puternice sau slabe. În rășinile puternic bazice cromatul poate fi îndepărtat deoarece ionii HCrO4- și CRDouăSAU7Două- sunt schimbate cu ioni OH- și Cl-. În rășinile slab bazice, de exemplu rășinile sulfatate, ionii sunt schimbați cu SO4Două-.
În cazul rășinilor R- (OH) puternic bazice, reacțiile generale sunt următoarele:
2ROH + HCrO4- + H+ ⇔ RDouăCrO4 + 2HDouăSAU
RDouăCrO4 + 2HCrO4- ⇔ 2RHCrO4 + CrO4Două-
RDouăCrO4 + HCrO4- + H+ ⇔ RDouăCrDouăSAU7 + HDouăSAU
Pentru fiecare mol de RDouăCrO4 transformat, un mol de Cr (VI) este eliminat din soluție, ceea ce face această metodă foarte atractivă..
După îndepărtarea cromatilor, rășina este tratată cu o soluție puternic alcalină pentru a le regenera într-un loc sigur. Apoi, cromații sunt transformați în acid cromic concentrat pentru a fi reutilizați..
Prin regenerare electrochimică
O altă metodă este regenerarea electrochimică a acidului crom, care este, de asemenea, o alternativă foarte convenabilă. Prin acest proces, cromul (III) este oxidat anodic în crom (VI). Materialul anodic în aceste cazuri este de preferință dioxid de plumb..
Utilizarea microorganismelor pentru curățarea efluenților cu urme de acid cromic
O metodă care a fost investigată și este încă în studiu este utilizarea microorganismelor prezente în mod natural în anumiți efluenți contaminați cu ioni hexavalenți de crom, care sunt cei conținuți în soluțiile de acid cromic..

Acesta este cazul anumitor bacterii prezente în apele uzate de tăbăcire a pielii. Acești microbi au fost studiați și s-a stabilit că sunt rezistenți la cromați și sunt, de asemenea, capabili să reducă cromul (VI) la cromul (III), care este mult mai puțin dăunător mediului și ființelor vii..
Din acest motiv, se estimează că pot fi folosite ca metodă ecologică pentru remedierea și detoxifierea efluenților contaminați cu urme de acid cromic..
Pericole legate de acidul crom și oxidul cromic
CrO3 Nu este combustibil, dar poate intensifica arderea altor substanțe. Multe dintre reacțiile lor pot provoca incendii sau explozii.
CrO3 și soluțiile de acid cromic sunt iritante puternice pentru piele (pot provoca dermatită), ochi (pot arde) și mucoase (pot provoca bronhoasma) și pot provoca așa-numitele "găuri de crom" în sistemul respirator.
Compușii cromului (VI), cum ar fi acidul crom și oxidul crom, sunt grav toxici, mutageni și cancerigeni pentru majoritatea ființelor vii..
Referințe
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.
- S.U.A. Biblioteca Națională de Medicină. (2019). Acid cromic. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Wegman, R.F. și Van Twisk, J. (2013). Aluminiu și aliaje de aluminiu. 2.5. Procesul de anodizare a acidului crom. În tehnicile de pregătire a suprafețelor pentru lipirea adezivă (ediția a doua). Recuperat de la sciencedirect.com.
- Wegman, R.F. și Van Twisk, J. (2013). Magneziu. 6.4. Pregătirea aliajelor de magneziu și magneziu prin procesele de tratament cu acid cromic. În tehnicile de pregătire a suprafeței pentru lipirea adezivă (ediția a doua). Recuperat de la sciencedirect.com.
- Grot, W. (2011). Aplicații. 5.1.8. Regenerarea acidului cromic. În Ionomeri fluorurați (ediția a doua). Recuperat de la sciencedirect.com.
- Swift, K.G. și Booker, J.D. (2013). Procese de inginerie de suprafață. 9.7. Cromare. În manualul de selecție a proceselor de fabricație. Recuperat de la sciencedirect.com.
- Poulsson, A.H.C. și colab. (2019). Tehnici de modificare a suprafeței PEEK, inclusiv tratarea suprafeței cu plasmă. 11.3.2.1. Gravarea suprafeței. În manualul PEEK Biomaterials (ediția a doua). Recuperat de la sciencedirect.com.
- Westheimer, F.H. (1949). Mecanismele oxidărilor acidului cromic. Chemical Reviews 1949, 45, 3, 419-451. Recuperat de la pubs.acs.org.
- Tan, H.K.S. (1999). Eliminarea acidului crom prin Anion Exchange. Jurnalul canadian de inginerie chimică, volumul 77, februarie 1999. Recuperat de la onlinelibrary.wiley.com.
- Kabir, M.M. și colab. (2018). Izolarea și caracterizarea bacteriilor care reduc cromul (VI) din efluenții de tăbăcire și deșeurile solide. Jurnalul Mondial de Microbiologie și Biotehnologie (2018) 34: 126. Recuperat de la ncbi.nlm.nih.gov.



Nimeni nu a comentat acest articol încă.