
Structura acidului fumaric, proprietăți, utilizări și riscuri

acid fumaric sau acidul trans-butenedioic este un acid dicarboxilic slab care intervine în ciclul Krebs (sau ciclul acidului tricarboxilic) și în ciclul ureei. Structura sa moleculară este HOOCCH = CHCOOH, a cărei formulă moleculară condensată este C4H4SAU4. Sărurile și esterii acidului fumaric se numesc fumarați.
Este produs în ciclul Krebs din succinat care este oxidat în fumarat prin acțiunea enzimei succinat dehidrogenază, folosind FAD (Flavin Adenil Dinucleotide) ca coenzimă. În timp ce FAD este redus la FADHDouă. Ulterior, fumaratul este hidratat la L-malat prin acțiunea enzimei fumarază.
În ciclul ureei, arginosuccinatul este transformat în fumarat prin acțiunea enzimei arginosuccinat liasă. Fumaratul este transformat în malat de fumaraza citosolică.
Acidul fumaric poate fi obținut din glucoză într-un proces mediat de ciuperca Rhizopus nigricans. Acidul fumaric poate fi obținut și prin izomerizarea calorică a acidului maleic. Poate fi sintetizat și prin oxidarea furfuralului cu clorat de sodiu în prezența pentoxidului de vanadiu..
Acidul fumaric are multe utilizări; ca aditiv alimentar, producția de rășină și în tratamentul unor boli, cum ar fi psoriazisul și scleroza multiplă. Cu toate acestea, prezintă riscuri ușoare pentru sănătate care ar trebui luate în considerare..
Indice articol
- 1 Structura chimică
- 1.1 Izomeria geometrică
- 2 Proprietăți fizice și chimice
- 2.1 Formula moleculară
- 2.2 Greutate moleculară
- 2.3 Aspect fizic
- 2.4 Miros
- 2.5 Aromă
- 2.6 Punctul de fierbere
- 2.7 Punctul de topire
- 2.8 Punct de aprindere
- 2.9 Solubilitate în apă
- 2.10 Solubilitate în alte lichide
- 2.11 Densitatea
- 2.12 Presiunea vaporilor
- 2.13 Stabilitate
- 2.14 Autoinflamarea
- 2.15 Căldura de ardere
- 2,16 pH
- 2.17 Descompunerea
- 3 utilizări
- 3.1 În alimente
- 3.2 În producția de rășini
- 3.3 În medicină
- 4 Riscuri
- 5 Referințe
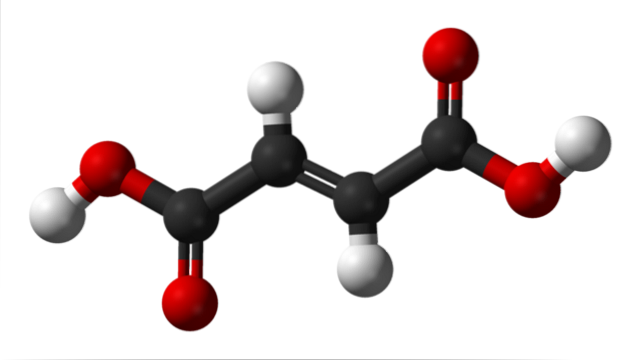
Structura chimică
Imaginea superioară ilustrează structura moleculară a acidului fumaric. Sferele negre corespund atomilor de carbon care alcătuiesc scheletul său hidrofob, în timp ce sferele roșii aparțin celor două grupuri carboxilice COOH. Astfel, ambele grupuri COOH sunt separate doar de doi atomi de carbon legați printr-o legătură dublă, C = C.
Se poate spune că structura acidului fumaric are geometrie liniară. Acest lucru se datorează faptului că toți atomii scheletului său carbonat au hibridizare spDouă și, prin urmare, se sprijină în același plan, în plus față de cei doi atomi centrali de hidrogen (cele două sfere albe, una orientată în sus și cealaltă orientată în jos).
Singurii doi atomi care ies din acest plan (și cu câteva unghiuri abrupte) sunt cei doi protoni acizi ai grupurilor COOH (sferele albe de pe laturi). Când acidul fumaric este complet deprotonat, el dobândește două sarcini negative care rezonează la capetele sale, devenind astfel un anion dibazic..
Izomeria geometrică
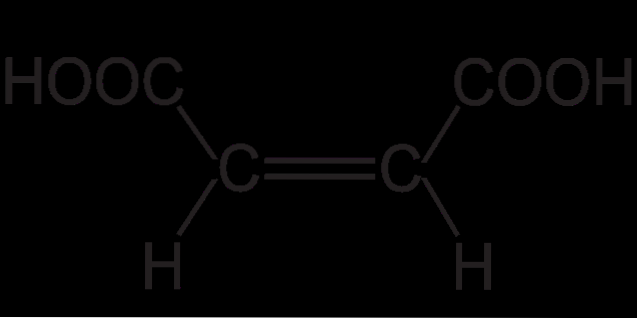
Structura acidului fumaric prezintă izomerism trans (sau E). Aceasta rezidă în pozițiile spațiale relative ale substituenților pe legătura dublă. Cei doi atomi de hidrogen mici indică în direcții opuse, la fel ca cele două grupuri COOH..
Acest lucru conferă acidului fumaric un schelet „în zigzag”. În timp ce pentru celălalt izomer geometric al său, cis (sau Z), care nu este altceva decât acid maleic, are un schelet curbat în formă de „C”. Această curbură este rezultatul întâlnirii frontale a celor două grupuri COOH și a celor două grupuri H în aceleași orientări:
Proprietati fizice si chimice
Formulă moleculară
C4H4SAU4.
Greutate moleculară
116,072 g / mol.
Aspectul fizic
Un solid cristalin incolor. Cristalele sunt monoclinice în formă de ac.
Pulbere sau granule cristaline albe.
Miros
Toaletă.
Gust
Fruct citric.
Punct de fierbere
329 ° F la o presiune de 1,7 mmmHg (522 ° C). Sublimează la 200º C (392º F) și se descompune la 287º C.
Punct de topire
572º F la 576º F (287º C).
Punct de aprindere
273º C (pahar deschis). 230º C (cupă închisă).
Solubilitatea apei
7.000 mg / l la 25 ° C.
Solubilitate în alte lichide
-Solubil în etanol și în acid sulfuric concentrat. Cu etanolul poate forma legături de hidrogen și, spre deosebire de moleculele de apă, cele ale etanolului interacționează cu o afinitate mai mare cu scheletul organic al structurii sale.
-Slab solubil în ester etilic și acetonă.
Densitate
1.635 g / cm3 la 68º F. 1.635 g / cm3 la 20 ° C.
Presiunea de vapori
1,54 x 10-4 mmHg la 25 ° C.
Stabilitate
Este stabil, deși este degradabil de către microorganisme aerobe și anaerobe.
Când acidul fumaric este încălzit într-un recipient închis cu apă între 150 ° C și 170 ° C, se formează acid DL-malic..
Auto-aprindere
1.634º F (375º C).
Căldura de ardere
2.760 cal / g.
pH
3,0-3,2 (soluție 0,05% la 25 ° C). Această valoare depinde de gradul de disociere a celor doi protoni, deoarece este un acid dicarboxilic și, prin urmare, diprotic..
Descompunere
Se descompune la încălzire, producând un gaz coroziv. Reacționează violent cu oxidanți puternici, creând gaze inflamabile și toxice care ar putea provoca incendii și chiar explozii.
La arderea parțială, acidul fumaric se transformă în anhidridă maleică iritantă..
Aplicații
În mâncare
-Este utilizat ca acidulant în alimente, îndeplinind o funcție de reglare a acidității. De asemenea, poate înlocui acidul tartric și acidul citric în acest scop. În plus, este folosit ca conservant alimentar.
-În industria alimentară, acidul fumaric este utilizat ca agent acru, aplicat băuturilor răcoritoare, vinurilor în stil occidental, băuturilor reci, sucurilor de fructe concentrate, conservelor de fructe, murăturilor, înghețatelor și băuturilor răcoritoare..
-Acidul fumaric este utilizat în băuturile de zi cu zi, cum ar fi laptele de ciocolată, ouă, cacao și laptele condensat. Acidul fumaric este, de asemenea, adăugat în brânză, inclusiv brânzeturi procesate și înlocuitori de brânză..
-Deserturile precum budinca, iaurtul aromat și sorbeturile pot conține acid fumaric. Acest acid poate conserva ouăle și deserturile pe bază de ouă, cum ar fi cremă..
Utilizări suplimentare în industria alimentară
-Acidul fumaric ajută la stabilizarea și aromarea alimentelor. Șuncă și conserve au, de asemenea, acest compus adăugat.
-Utilizarea sa combinată cu benzoați și acid boric este utilă împotriva degradării cărnii, a peștelui și a crustaceelor.
-Are proprietăți antioxidante, motiv pentru care a fost folosit în conservarea untului, a brânzeturilor și a laptelui praf..
-Facilitează manipularea aluatului de făină, permițând prelucrarea acestuia mai ușor.
-A fost utilizat cu succes în dieta porcilor în ceea ce privește creșterea în greutate, îmbunătățirea activității digestive și reducerea bacteriilor patogene din sistemul digestiv.
În producția de rășini
-Acidul fumaric este utilizat la producerea rășinilor poliesterice nesaturate. Această rășină are o rezistență excelentă la coroziune chimică și rezistență la căldură. În plus, este utilizat la fabricarea rășinilor alchidice, a rășinilor fenolice și a elastomerilor (cauciucurilor).
-Copolimerul acid fumaric / acetat de vinil este o formă de adeziv de înaltă calitate. Copolimerul acidului fumaric cu stirenul este o materie primă în fabricarea fibrelor de sticlă.
-A fost utilizat pentru producerea alcoolilor polihidrici și ca mordant de coloranți.
În medicină
-Fumaratul de sodiu poate reacționa cu sulfatul feros pentru a forma gelul de fumarat de fier, dând naștere medicamentului sub denumirea de Fersamal. Aceasta este, de asemenea, utilizată în tratamentul anemiei la copii.
-Esterul dimetil fumarat a fost utilizat în tratamentul sclerozei multiple, producând astfel o reducere a progresiei handicapului.
-În tratamentul psoriazisului s-au utilizat diferiți esteri ai acidului fumaric. Compușii acidului fumaric își vor exercita acțiunea terapeutică prin capacitatea lor imunomodulatoare și imunosupresoare..
-Planta Fumaria officinalis conține în mod natural acid fumaric și a fost utilizată de zeci de ani în tratamentul psoriazisului.
Cu toate acestea, la un pacient tratat cu acid fumaric pentru psoriazis au fost observate insuficiență renală, afectarea funcției hepatice, efecte gastro-intestinale și înroșirea feței. Tulburarea a fost diagnosticată ca Necroză Tubulară Acută.
Experimente cu acest compus
-Într-un experiment pe oameni cărora li s-au administrat 8 mg acid fumaric / zi timp de un an, niciunul dintre participanți nu a prezentat leziuni hepatice.
-Acidul fumaric a fost utilizat pentru a inhiba tumorile hepatice induse de tiocetamidă la șoareci..
-A fost utilizat la șoarecii tratați cu mitomicină C. Acest medicament provoacă anomalii hepatice, constând din diverse modificări citologice, cum ar fi neregularități perinucleare, agregare a cromatinei și organite citoplasmatice anormale. De asemenea, acidul fumaric reduce incidența acestor modificări.
-În experimentele cu șobolani, acidul fumaric a demonstrat o capacitate inhibitoare pentru dezvoltarea papilomului esofagian, a gliomului cerebral și a tumorilor mezenchimale ale rinichiului..
-Există experimente care arată un efect opus al acidului fumaric în raport cu tumorile canceroase. Recent a fost identificat ca un oncometabolit sau metabolit endogen capabil să provoace cancer. Există nivele ridicate de acid fumaric în tumori și în lichidul din jurul tumorii.
Riscuri
-În contact cu ochii, pudra de acid fumaric poate provoca iritații, manifestate prin roșeață, rupere și durere.
-În contact cu pielea poate provoca iritații și roșeață.
-Inhalarea poate irita membrana mucoasă a căilor nazale, laringelui și gâtului. De asemenea, poate provoca tuse sau dificultăți de respirație..
-Pe de altă parte, acidul fumaric nu prezintă toxicitate atunci când este ingerat..
Referințe
- Steven A. Hardinger. (2017). Glosar ilustrat de chimie organică: acid fumaric. Luat din: chem.ucla.edu
- Grupul Transmerquim. (August 2014). Acid fumaric. [PDF]. Preluat de pe: gtm.net
- Wikipedia. (2018). Acid fumaric. Luat de la: en.wikipedia.org/wiki/Fumaric_acid
- PubChem. (2018). Acid fumaric. Luat de la: pubchem.ncbi.nlm.nih.gov
- Societatea Regală de Chimie. (2015). Acid fumaric. Luat de pe: chemspider.com
- ChemicalBook. (2017). Acid fumaric. Preluat de pe: chemicalbook.com



Nimeni nu a comentat acest articol încă.