
Caracteristici ale acidului manganic sau permanganic, utilizări
acid manganic sau permanganic este un acid dibazic cu formula H2MnO4, format din mangan, analog acidului sulfuric. Se găsește numai în soluție și în săruri de manganat.
- Numele sistematic: Dihidrogen (tetraoxidomanganat).
- Tipul compusului: Oxoacizi (combinații ternare formate din hidrogen, un element nemetalic și oxigen).
- Formulă moleculară: H2MnO4
- Masa moleculara: 120.9515

Exemple de reacții
MnO3 + H2O = H2MnO4
KMnO4 + H2O2 = KO2 + H2MnO4
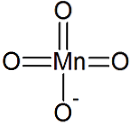
Caracteristici
Soluțiile de acid permanganic (până la 20%) sunt lichide violete, cu miros de ozon. Hidratul de cristal (HMnO4 · 2H2O) este un solid cristalin purpuriu care se descompune peste 20 de grade Celsius.
Acidul permanganic este un oxidant foarte puternic, deși mai blând decât anhidrida sa. Se descompune spontan, înghițind oxigenul și precipitând dioxid de mangan, care catalizează descompunerea acidă suplimentară.
Prin răcirea soluției de acid concentrat instabil aproape de punctul de îngheț, se poate prepara cristal hidrat. Sursele variază în funcție de natura acestui compus: conform unor surse, este o sare de hidroniu a acidului permanganic, după altele, este un complex de acid polimanganic.
Soluțiile excesiv de concentrate ale acestui acid se pot descompune spontan odată cu evoluția ozonului. Acest lucru permite prepararea chimică a ozonului prin reacția permanganatului de potasiu cu acidul sulfuric cu concentrație medie (50-80%)..
Această reacție produce o soluție excesiv de concentrată de acid permanganic, care se descompune rapid, eliberând ozon..
Acidul sulfuric cu o concentrație de peste 80% nu trebuie utilizat pentru această reacție, deoarece acest lucru poate duce la formarea de anhidridă (epoxid de mangan), care este extrem de periculos..
Pregătirea
Acidul permanganic poate fi preparat prin dizolvarea epoxidului de mangan în apă sau prin reacția permanganatului de bariu cu acidul sulfuric. O soluție impură poate fi preparată și prin dizolvarea permanganatului de potasiu în acid sulfuric cu concentrație medie (50-80%)..
Conducere
Nu se știu prea multe despre pericolele acidului permanganic, dar trebuie tratat cu prudență, deoarece este un acid puternic și un oxidant foarte puternic. De asemenea, poate elibera ozon, care este toxic.
Depozitare
Nu este practic să păstrați acest acid datorită instabilității sale. Ar trebui să fie utilizat de îndată ce este terminat. Hidratul poate fi depozitat atât timp cât este înghețat (sub punctul de îngheț al apei).
Dispoziţie
Acidul permanganic poate fi deversat în sol, deoarece provoacă descompunerea compusului, oxidând solul și transformându-se în dioxid de mangan, care este sigur și insolubil..
Permanganate
Grupa anionică univalentă MnO4 derivată din acidul permanganic fiind toți agenți oxidanți puternici. Sunt săruri care conțin anionul MnO4-, în mod normal de culoare roșu-purpuriu intens și cu puternice proprietăți oxidante..
1- Permanganat de potasiu
Formula moleculară: KMnO4
Greutate moleculară: 158,032 g / mol
Este cel mai cunoscut dintre toate permanganatele. De asemenea, cunoscut sub numele de cristale Condy, este un compus foarte oxidant, inodor, solubil în apă și în mulți solvenți organici, are cristale purpurii și un gust dulce. (Definiție din Dicționarul de informații științifice și tehnice McGraw-Hill, ediția a 4-a).
Permanganatul de potasiu nu este combustibil, dar accelerează aprinderea materialului combustibil. Dacă materialul combustibil este divizat fin, amestecul poate fi exploziv. Când este în contact cu materiale combustibile lichide, acesta poate provoca aprinderea spontană. În contact cu acidul sulfuric, poate provoca incendii sau explozii. Folosit pentru a produce alte substanțe chimice și ca dezinfectant.
Farmacologie și biochimie
Clasificare farmacologică: MeSH
Indicatori și reactivi
Sunt substanțe utilizate pentru detectarea, identificarea și analiza proceselor sau condițiilor chimice, biologice sau patologice..
Indicatorii sunt substanțe care se schimbă în aspectul fizic, de exemplu culoarea, atunci când se apropie de punctul în care trece între aciditate și alcalinitate. Reactivii sunt substanțe utilizate pentru detectarea sau determinarea unei alte substanțe prin mijloace chimice sau microscopice, în special analize.
Tipurile de reactivi sunt precipitanții, solvenții, oxidanții, reductorii, fluxurile și reactivii colorimetrici. (Dicționarul chimic al lui Hackh, ediția a 5-a, pag. 301, pag. 499).
Utilizare industrială
Ca agenți de înălbire, agenți de miros și agenți de oxidare / reducere.
Metode de fabricație
Pot fi preparate prin oxidarea dioxidului de mangan cu clorat de potasiu în soluție de hidroxid de potasiu, apoi completarea oxidării cu clor sau aer și dioxid de carbon..
Siguranță și pericole
-Poate intensifica focul.
-Daunator daca e inghitit.
- Provoacă arsuri severe ale pielii.
- Poate provoca leziuni oculare.
-Poate provoca iritații ale căilor respiratorii.
- Bănuit de a provoca defecte genetice.
- Se suspectează că poate dăuna fertilității și fătului.
- Provoacă leziuni ale organelor prin expunere prelungită sau repetată.
- Este foarte toxic pentru organismele acvatice, cu efecte de lungă durată..
Pericol pentru sanatate
Poate provoca arsuri și pete de culoare maro închis. Dacă este ingerat, acesta afectează grav sistemul gastro-intestinal. Poate fi fatal dacă este consumat peste 4 uncii.
Pericol de incendiu
Nu este combustibil, dar mărește arderea altor substanțe. Provoacă gaze sau vapori iritanți sau toxici în foc.
Comportament în caz de incendiu: poate provoca incendii în contact cu combustibili, provocând explozia containerelor. Poate provoca un risc mare de incendiu și explozie în contact cu substanțe combustibile sau agenți reducători.
Pericole chimice
Se descompune atunci când este încălzit și acest lucru produce gaze toxice și vapori iritanți. Substanța este un oxidant puternic. Reacționează cu materiale combustibile și reducătoare care generează pericol de incendiu și explozie. Reacționează violent cu metalele sub formă de pulbere, creând un pericol de incendiu.
Primul ajutor dacă intrați în contact cu permanganat de potasiu
Dacă este ingerat, provocați vărsături și urmați cu un lavaj gastric complet.
Dacă este inhalat, sunt necesare aer proaspăt și odihnă. Respirația artificială poate fi necesară. Este necesar să consultați un medic.
Dacă vine în contact cu pielea, clătiți cu multă apă timp de cel puțin 15 minute, apoi îndepărtați hainele contaminate și clătiți din nou. De asemenea, este important să consultați un medic.
Dacă intră în contact cu ochii, clătiți cu multă apă timp de câteva minute. Solicitați asistență medicală.
2- Permanganat de sodiu
Formula moleculară: MnNaO4
Greutate moleculară: 141,924 g / mol
Permanganatul de sodiu este un solid cristal purpuriu. Incombustibil, dar accelerează arderea materialului combustibil. Se poate aprinde spontan în contact cu materiale combustibile lichide. Contactul cu acid sulfuric poate provoca incendii sau explozii. Utilizat în medicină, ca dezinfectant și pentru multe alte utilizări.
Utilizare și fabricare
Este utilizat în industrie ca agent oxidant și reducător. Este, de asemenea, utilizat pentru tratarea apei, pentru albirea textilelor
Metode de fabricație
Manganatul de sodiu se dizolvă în apă și se introduce clor sau ozon. Soluția este concentrată și cristalizată.
3- Permanganat de calciu
Formula moleculară: CaMn2O8
Greutate moleculară: 277,946 g / mol
Caracteristici
Permanganatul de calciu este un solid cristal purpuriu. Este utilizat ca dezinfectant și dezodorizant, în purificarea apei și pentru multe alte utilizări.
Utilizare medicală
Ionul manganic rezultat din acest permanganat este astringent, ceea ce ajută la suprimarea inflamației.


Nimeni nu a comentat acest articol încă.