
Structura acidului azotic (HNO3), proprietăți, sinteză și utilizări
acid azotic Este un compus anorganic format dintr-un azot oxo acid. Este considerat un acid puternic, deși pKa (-1,4) este similar cu pKa ionului hidroniu (-1,74). Din acest moment, este probabil cel mai slab dintre mulți acizi puternici cunoscuți..
Aspectul său fizic constă dintr-un lichid incolor care la depozitare se transformă într-o culoare gălbuie, datorită formării gazelor azotate. Formula sa chimică este HNO3.

Este oarecum instabil, suferind o ușoară descompunere din cauza expunerii la lumina soarelui. În plus, poate fi complet descompus prin încălzire, dând naștere la dioxid de azot, apă și oxigen..
Imaginea de mai sus prezintă acid nitric conținut într-un balon volumetric. Se observă colorația sa galbenă, indicativă a unei descompuneri parțiale.
Se folosește la fabricarea nitraților anorganici și organici, precum și la compușii nitrozoizi care sunt folosiți la fabricarea îngrășămintelor, a explozivilor, a agenților intermediari pentru coloranți și a diferiților compuși chimici organici..
Acest acid era deja cunoscut de alchimiștii din secolul al VIII-lea, pe care îl numeau „agua fortis”. Chimistul german Johan Rudolf Glauber (1648) a conceput o metodă de preparare a acestuia, care consta în încălzirea azotatului de potasiu cu acid sulfuric.
Se prepară industrial urmând metoda proiectată de Wilhelm Oswald (1901). Metoda, în general, constă în oxidarea catalitică a amoniului, cu generarea succesivă de oxid azotic și dioxid de azot pentru a forma acid azotic..
În atmosferă, NUDouă produsă de activitatea umană reacționează cu apa din nori, formând HNO3. Apoi, în timpul ploilor acide, precipită împreună cu picături de apă, mâncând, de exemplu, statui în piețele publice..
Acidul azotic este un compus foarte toxic, iar expunerea continuă la vaporii săi poate duce la bronșită cronică și pneumonie chimică..
Indice articol
- 1 Structura acidului azotic
- 1.1 Structuri de rezonanță
- 2 Proprietăți fizice și chimice
- 2.1 Denumiri chimice
- 2.2 Greutate moleculară
- 2.3 Aspect fizic
- 2.4 Miros
- 2.5 Punctul de fierbere
- 2.6 Punct de topire
- 2.7 Solubilitatea în apă
- 2.8 Densitate
- 2.9 Densitatea relativă
- 2.10 Densitatea relativă a vaporilor
- 2.11 Presiunea vaporilor
- 2.12 Descompunerea
- 2.13 Vâscozitatea
- 2.14 Coroziune
- 2.15 Entalpia molară de vaporizare
- 2.16 Entalpia molară standard
- 2.17 Entropie molară standard
- 2.18 Tensiunea superficială
- 2.19 Pragul mirosului
- 2.20 Constanta de disociere
- 2.21 Indicele de refracție (η / D)
- 2.22 Reacții chimice
- 3 Sinteza
- 3.1 Industrial
- 3.2 În laborator
- 4 utilizări
- 4.1 Producția de îngrășăminte
- 4.2 Industrial
- 4.3 Purificator de metale
- 4.4 Aqua regia
- 4.5 Mobila
- 4.6 Curățarea
- 4.7 Fotografie
- 4.8 Altele
- 5 Toxicitate
- 6 Referințe
Structura acidului azotic
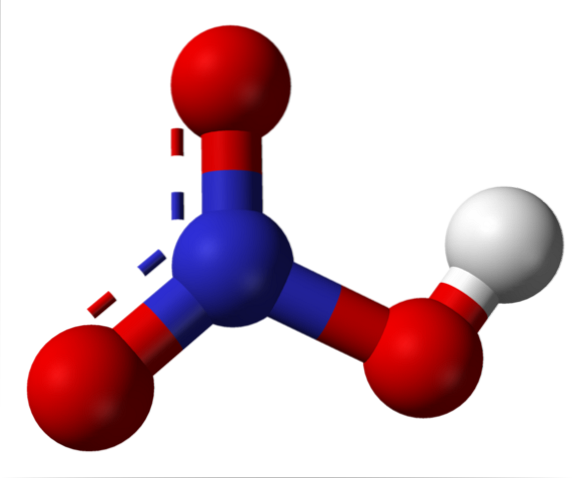
Imaginea superioară arată structura unei molecule de HNO.3 cu un model de sfere și bare. Atomul de azot, sfera albastră, este situat în centru, înconjurat de o geometrie plană trigonală; cu toate acestea, triunghiul este distorsionat de unul dintre cele mai lungi vârfuri ale sale.
Moleculele de acid azotic sunt apoi plate. Legăturile N = O, N-O și N-OH formează vârfurile triunghiului plat. Dacă se observă în detaliu, legătura N-OH este mai alungită decât celelalte două (unde se găsește sfera albă care reprezintă atomul H).
Structuri de rezonanță
Există două legături care au aceeași lungime: N = O și N-O. Acest fapt se opune teoriei legăturilor de valență, unde se prezice că legăturile duble vor fi mai scurte decât legăturile simple. Explicația pentru aceasta rezidă în fenomenul rezonanței, așa cum se vede în imaginea de mai jos.

Ambele legături, N = O și N-O, sunt deci echivalente din punct de vedere al rezonanței. Aceasta este reprezentată grafic în modelul de structură utilizând o linie întreruptă între doi atomi de O (vezi structura).
Când HNO este deprotonat3, se formează azotul de anion stabil NO3-. În el, rezonanța implică acum toți cei trei atomi O. Acesta este motivul pentru care HNO3 are o aciditate Bronsted-Lowry ridicată (specii donatoare de ioni H+).
Proprietati fizice si chimice
Denumiri chimice
-Acid azotic
-Acid azotic
-Azotat de hidrogen
-Fortis apă.
Greutate moleculară
63,012 g / mol.
Aspectul fizic
Lichid incolor sau galben pal, care poate deveni maroniu roșiatic.
Miros
Caracteristică înțepătoare, înăbușitoare.
Punct de fierbere
181ºF la 760mmHg (83ºC).
Punct de topire
-41,6 ºC.
Solubilitatea apei
Foarte solubil și miscibil cu apa.
Densitate
1,513 g / cm3 la 20 ° C.
Densitate relativa
1,50 (în raport cu apa = 1).
Densitatea relativă a vaporilor
De 2 sau 3 ori estimat (în raport cu aerul = 1).
Presiunea de vapori
63,1 mmHg la 25 ° C.
Descompunere
La expunerea la umiditate sau căldură atmosferică, se poate descompune pentru a forma peroxid de azot. Când este încălzit până la descompunere, emite un fum foarte toxic de oxid de azot și azotat de hidrogen..
Acidul nitric nu este stabil, putându-se descompune în contact cu căldura și expunerea la lumina soarelui și emițând dioxid de azot, oxigen și apă..
Viscozitate
1.092 mPa la 0 ° C și 0,617 mPa la 40 ° C.
Coroziune
Este capabil să atace toate metalele de bază, cu excepția aluminiului și a oțelului crom. Atacă unele dintre varietățile de materiale plastice, cauciucuri și acoperiri. Este o substanță caustică și corozivă, deci trebuie manipulată cu extremă prudență.
Entalpia molară de vaporizare
39,1 kJ / mol la 25 ° C.
Entalpia molară standard
-207 kJ / mol (298 ºF).
Entropie molară standard
146 kJ / mol (298 ºF).
Tensiune de suprafata
-0,04356 N / m la 0 ° C
-0,04115 N / m la 20 ° C
-0,0376 N / m la 40 ° C
Pragul mirosului
-Miros redus: 0,75 mg / m3
-Miros ridicat: 250 mg / m3
-Concentrație iritantă: 155 mg / m3.
Constanta de disociere
pKa = -1,38.
Indicele de refracție (η / D)
1,393 (16,5 ºC).
Reacții chimice
Hidratare
-Poate forma hidrați solizi, cum ar fi HNO3∙ HDouăO și HNO3∙ 3HDouăSau: „gheață azotată”.
Disocierea în apă
Acidul azotic este un acid puternic care se ionizează rapid în apă după cum urmează:
HNO3 (l) + HDouăO (l) => H3SAU+ (ac) + NR3-
Formarea sării
Reacționează cu oxizii bazici pentru a forma o sare de nitrat și apă.
CaO (s) + 2 HNO3 (l) => Ca (NO3)Două (ac) + HDouăO (l)
La fel, reacționează cu baze (hidroxizi), formând o sare de azotat și apă..
NaOH (aq) + HNO3 (l) => NaNO3 (ac) + HDouăO (l)
Și, de asemenea, cu carbonați și carbonați acizi (bicarbonați), formând, de asemenea, dioxid de carbon.
N / ADouăCO3 (ac) + HNO3 (l) => NaNO3 (ac) + HDouăO (l) + CODouă (g)
Protonare
Acidul azotic se poate comporta și ca bază. Din acest motiv, poate reacționa cu acidul sulfuric.
HNO3 + 2HDouăSW4 <=> NUDouă+ + H3SAU+ + 2HSO4-
Autoprotoliză
Acidul azotic este supus autoprotolizei.
2HNO3 <=> NUDouă+ + NU3- + HDouăSAU
Oxidarea metalelor
În reacția cu metalele, acidul azotic nu se comportă ca acizii puternici, care reacționează cu metalele, formând sarea corespunzătoare și eliberând hidrogen în formă gazoasă..
Cu toate acestea, magneziul și manganul reacționează fierbinte cu acidul azotic, la fel ca și ceilalți acizi puternici..
Mg (s) + 2 HNO3 (l) => Mg (NO3)Două (ac) + HDouă (g)
Alte
Acidul azotic reacționează cu sulfitii metalici pentru a forma o sare de nitrat, dioxid de sulf și apă..
N / ADouăSW3 (s) + 2 HNO3 (l) => 2 NaNO3 (ac) + SODouă (g) + HDouăO (l)
Și reacționează și cu compuși organici, substituind un hidrogen cu o grupare nitro; constituind astfel baza pentru sinteza compușilor explozivi precum nitroglicerina și trinitrotoluenul (TNT).
Sinteză
Industrial
Este produs la nivel industrial prin oxidarea catalitică a amoniului, conform metodei descrise de Oswald în 1901. Procedura constă în trei etape sau etape.
Etapa 1: Oxidarea amoniului în oxid nitric
Amoniacul este oxidat de oxigenul din aer. Reacția este efectuată la 800 ° C și la o presiune de 6-7 atm, cu utilizarea platinei ca catalizator. Amoniacul este amestecat cu aer cu următorul raport: 1 volum de amoniac la 8 volume de aer.
4NH3 (g) + 5ODouă (g) => 4NO (g) + 6HDouăO (l)
Oxidul nitric este produs în reacție, care este dus în camera de oxidare pentru etapa următoare..
Etapa 2. Oxidarea oxidului nitric în dioxid de azot
Oxidarea este efectuată de oxigenul prezent în aer la o temperatură sub 100 ° C.
2NO (g) + ODouă (g) => 2NODouă (g)
Etapa 3. Dizolvarea dioxidului de azot în apă
În această etapă are loc formarea acidului azotic.
4NODouă + 2HDouăO + ODouă => 4HNO3
Există mai multe metode de absorbție a dioxidului de azot (NODouă) in apa.
Printre alte metode: NUDouă este dimerizat la NDouăSAU4 la temperaturi scăzute și presiune ridicată, pentru a-și crește solubilitatea în apă și a produce acid azotic.
3NDouăSAU4 + 2HDouăO => 4HNO3 + 2NO
Acidul azotic produs de oxidarea amoniacului are o concentrație între 50-70%, care poate fi adusă la 98% prin utilizarea acidului sulfuric concentrat ca agent de deshidratare, permițând creșterea concentrației de acid azotic..
La laborator
Descompunerea termică a azotatului de cupru (II), producând dioxid de azot și gaze de oxigen, care sunt trecute prin apă pentru a forma acid azotic; ca și în metoda Oswald, descrisă anterior.
2Cu (NR3)Două => 2CuO + 4NODouă + SAUDouă
Reacția unei sări de nitrat cu HDouăSW4 concentrat. Acidul azotic format este separat de HDouăSW4 prin distilare la 83 ° C (punctul de fierbere al acidului azotic).
KNO3 + HDouăSW4 => HNO3 + KHSO4
Aplicații
Producția de îngrășăminte
60% din producția de acid azotic este utilizată la fabricarea îngrășămintelor, în special azotat de amoniu.
Aceasta se caracterizează prin concentrația sa ridicată de azot, unul dintre cei trei nutrienți principali ai plantelor, azotatul fiind utilizat imediat de plante. Între timp, amoniacul este oxidat de microorganismele prezente în sol și este utilizat ca îngrășământ pe termen lung..
Industrial
-15% din producția de acid azotic este utilizată la fabricarea fibrelor sintetice.
-Se utilizează la producerea esterilor acidului azotic și a derivaților nitro; cum ar fi nitroceluloză, vopsele acrilice, nitrobenzen, nitrotoluen, acrilonitrili etc..
-Poate adăuga grupări nitro compușilor organici, iar această proprietate poate fi utilizată pentru a produce explozivi precum nitroglicerina și trinitrotoluenul (TNT)..
-Acidul adipic, un precursor al nailonului, este produs pe scară largă prin oxidarea ciclohexanonei și ciclohexanolului de către acidul azotic..
Purificator de metale
Acidul nitric, datorită capacității sale de oxidare, este foarte util în purificarea metalelor prezente în minerale. De asemenea, este utilizat pentru obținerea de elemente precum uraniu, mangan, niobiu, zirconiu și în acidificarea rocilor fosforice pentru a obține acid fosforic..
Apă regală
Se amestecă cu acid clorhidric concentrat pentru a forma „aqua regia”. Această soluție este capabilă să dizolve aurul și platina, ceea ce permite utilizarea sa în purificarea acestor metale..
Mobila
Acidul azotic este folosit pentru a obține un efect antic în mobilierul realizat din lemn de pin. Tratamentul cu o soluție de acid azotic 10% produce o culoare gri-aurie în lemnul mobilierului.
Curățare
-Amestecul de soluții apoase de acid azotic 5-30% și acid fosforic 15-40% este utilizat la curățarea echipamentului utilizat în munca de muls, pentru a elimina reziduurile precipitatelor compușilor de magneziu și calciu.
-Este util în curățarea obiectelor din sticlă utilizate în laborator.
Fotografie
-Acidul azotic a fost folosit în fotografie, în special ca aditiv la dezvoltatorii de sulfat feros în procesul de plăci umede, pentru a promova o culoare mai albă în ambrotipuri și tipuri..
-A fost folosit pentru scăderea pH-ului băii de argint a plăcilor de colodion, ceea ce a permis obținerea unei reduceri a aspectului unei cețe care a interferat cu imaginile.
Alții
-Datorită capacității sale de solvent, este utilizat în analiza diferitelor metale prin tehnici de spectrofotometrie de absorbție atomică cu flacără și spectrofotometrie de masă cuplată inductiv..
-Combinația de acid azotic și acid sulfuric a fost utilizată pentru conversia bumbacului obișnuit în azotat de celuloză (bumbac azotic).
-Medicamentul Salcoderm pentru uz extern este utilizat în tratamentul neoplasmelor benigne ale pielii (negi, bataturi, condiloame și papiloame). Are proprietăți de cauterizare, ameliorare a durerii, iritații și mâncărime. Acidul azotic este componenta principală a formulei medicamentoase.
-Acidul azotic fumant roșu și acidul azotic fumant alb sunt folosite ca oxidanți pentru combustibilii lichizi pentru rachete, în special în racheta BOMARC..
Toxicitate
-În contact cu pielea, poate provoca arsuri ale pielii, dureri severe și dermatită..
-În contact cu ochii poate provoca dureri severe, rupere și, în cazuri severe, leziuni ale corneei și orbire..
-Inhalarea vaporilor poate provoca tuse, suferință respiratorie, provocând sângerări nazale, laringită, bronșită cronică, pneumonie și edem pulmonar în expuneri severe sau cronice..
-Datorită ingestiei sale, există leziuni la nivelul gurii, salivație, sete intensă, durere de înghițit, durere intensă în tot tractul digestiv și risc de perforare a peretelui acestuia..
Referințe
- Wikipedia. (2018). Acid azotic. Recuperat de pe: en.wikipedia.org
- PubChem. (2018). Acid azotic. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Editorii Enciclopediei Britanice. (23 noiembrie 2018). Acid azotic. Encyclopædia Britannica. Recuperat de pe: britannica.com
- Shrestha B. (s.f.). Proprietățile acidului azotic și utilizări. Ghid chimic: tutoriale pentru învățarea chimiei. Recuperat de la: chem-guide.blogspot.com
- Carte chimică. (2017). Acid azotic. Recuperat de pe: chemicalbook.com
- Imanol. (10 septembrie 2013). Producția de acid azotic. Recuperat de pe: ingenieriaquimica.net



Nimeni nu a comentat acest articol încă.