
Structura, proprietățile și utilizările selenurii de hidrogen (H2Se)

hidrogen seleniu sau selenura de hidrogen este un compus anorganic a cărui formulă chimică este HDouăStiu. Este de natură covalentă, iar în condiții obișnuite de temperatură și presiune este un gaz incolor; dar cu un miros puternic recunoscut pentru prezența sa mai mică. Din punct de vedere chimic, este o calcogenură, deci seleniul are o valență de -2 (SeDouă-).
Dintre toate selenidele, HDouăEste cel mai toxic, deoarece molecula sa este mică, iar atomul său de seleniu are mai puține obstacole sterice atunci când reacționează. Pe de altă parte, mirosul său permite celor care lucrează cu acesta să îl detecteze la fața locului în cazul unei scurgeri în afara capotei de laborator..
Selenura de hidrogen poate fi sintetizată prin combinația directă a celor două elemente ale sale: hidrogen molecular, HDouă, și seleniu metalic. Poate fi obținut și prin dizolvarea compușilor bogați în seleniu, cum ar fi selenura de fier (II), FeSe, în acid clorhidric..
Pe de altă parte, selenura de hidrogen este preparată prin dizolvarea selenurii de hidrogen în apă; adică prima este dizolvată în apă, în timp ce a doua constă din molecule gazoase.
Utilizarea sa principală este de a fi o sursă de seleniu în sinteza organică și anorganică.
Indice articol
- 1 Structura selenurii de hidrogen
- 2 Proprietăți
- 2.1 Aspect fizic
- 2.2 Masa moleculară
- 2.3 Punctul de fierbere
- 2.4 Punct de topire
- 2.5 Presiunea vaporilor
- 2.6 Densitate
- 2,7 pKa
- 2.8 Solubilitatea în apă
- 2.9 Solubilitate în alți solvenți
- 3 Nomenclatură
- 3.1 Selenură sau hidrură?
- 4 utilizări
- 4.1 Metabolice
- 4.2 Industrial
- 5 Referințe
Structura selenurii de hidrogen
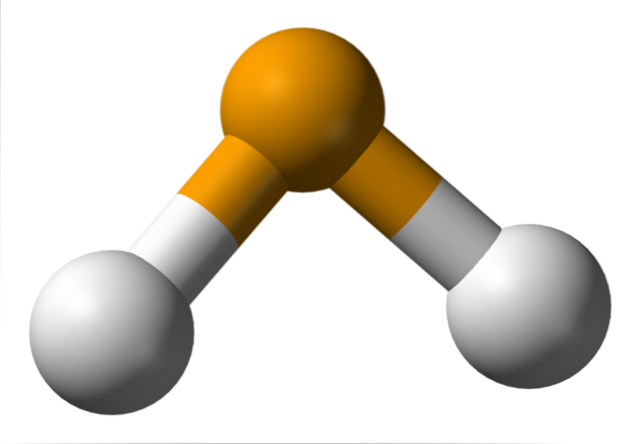
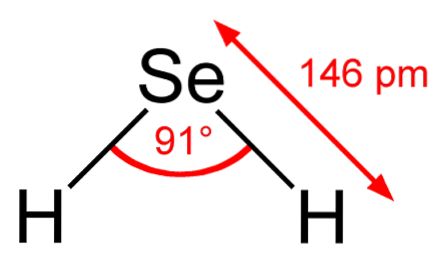
În imaginea superioară se observă că molecula de HDouăEste de geometrie unghiulară, deși unghiul său de 91 ° îl face să arate mai mult ca un L decât un V. În acest model de sfere și tije, atomii de hidrogen și seleniu sunt sferele albe și respectiv galbene..
Această moleculă, așa cum se arată, este cea din faza gazoasă; adică pentru selenura de hidrogen. Când este dizolvat în apă, eliberează un proton și în soluție avem perechea HSe- H3SAU+; această pereche de ioni ajunge la selenura de hidrogen, notată ca HDouăSe (ac) pentru a-l diferenția de selenura de hidrogen, HDouăSe (g).
Prin urmare, structurile dintre HDouăSe (ac) și HDouăSe (g) sunt foarte diferite; primul este înconjurat de o sferă apoasă și prezintă sarcini ionice, iar al doilea constă dintr-un aglomerat de molecule în faza gazoasă.
Molecule de HDouăAbia pot interacționa între ele prin forțe dipol-dipol foarte slabe. Seleniul, deși este mai puțin electronegativ decât sulful, concentrează o densitate mai mare de electroni prin „îndepărtarea” acestuia de la atomii de hidrogen..
Comprimate de hidruri de seleniu
Dacă moleculele de HDouăSunt supuși unei presiuni extraordinare (sute de GPa), teoretic sunt forțați să se solidifice prin formarea de legături Se-H-Se; Acestea sunt legături de trei centre și doi electroni (3c-2e) la care participă hidrogenul. Prin urmare, moleculele încep să formeze structuri polimerice care definesc un solid..
În aceste condiții, solidul poate fi îmbogățit cu mai mult hidrogen, ceea ce modifică complet structurile rezultate. În plus, compoziția devine tip HnSe, unde n variază de la 3 la 6. Astfel, hidrurile de seleniu comprimate de aceste presiuni și în prezența hidrogenului au formule chimice H3Vedeți la H6stiu.
Se estimează că aceste hidruri de seleniu îmbogățite cu hidrogen au proprietăți supraconductoare.
Proprietăți
Aspectul fizic
Gaz incolor care la temperaturi scăzute miroase a ridiche putredă și ouă putrede dacă crește concentrația sa. Mirosul său este mai rău și mai intens decât cel al hidrogenului sulfurat (care este deja destul de neplăcut). Cu toate acestea, acesta este un lucru bun, deoarece ajută la detectarea sa ușoară și reduce riscurile de contact prelungit sau inhalare..
Când arde, degajă un produs de flacără albăstruie al interacțiunilor electronice din atomii de seleniu.
Masa moleculara
80,98 g / mol.
Punct de fierbere
-41 ° C.
Punct de topire
-66 ° C.
Presiunea de vapori
9,5 atm la 21 ° C.
Densitate
3.553 g / L.
pKla
3,89.
Solubilitatea apei
0,70 g / 100 ml. Acest lucru confirmă faptul că atomul de seleniu al HDouăNu se pot forma legături de hidrogen apreciabile cu moleculele de apă.
Solubilitate în alți solvenți
-Solubil în CSDouă, ceea ce nu este surprinzător din cauza analogiei chimice dintre seleniu și sulf.
-Solubil în fosgen (la temperaturi scăzute, deoarece fierbe la 8 ° C).
Nomenclatură
După cum sa explicat deja în secțiunile anterioare, numele acestui compus variază în funcție de dacă HDouăEste în fază gazoasă sau dizolvat în apă. Când se află în apă, se numește hidrogen selenid, care nu este altceva decât un hidracid în termeni anorganici. Spre deosebire de moleculele gazoase, caracterul său acid este mai mare.
Cu toate acestea, fie ca gaz sau dizolvat în apă, atomul de seleniu păstrează aceleași caracteristici electronice; de exemplu, valența sa este -2, cu excepția cazului în care suferă o reacție de oxidare. Această valență de -2 este motivul pentru care se numește selenizimbru hidrogen, deoarece anionul selenidic este SeDouă-; care este mai reactiv și reducător decât SDouă-, sulfură.
Dacă se utilizează nomenclatura sistematică, trebuie specificat numărul de atomi de hidrogen din compus. Astfel, HDouăSe numește: selenid de a dathidrogen.
Selenidă sau hidrură?
Unele surse se referă la aceasta ca o hidrură. Dacă ar fi într-adevăr, seleniul ar avea o sarcină pozitivă de +2, iar hidrogenul ar avea o sarcină negativă de -1: SeHDouă (StiuDouă+, H-). Seleniul este un atom mai electronegativ decât hidrogenul și, prin urmare, ajunge să „acumuleze” cea mai mare densitate de electroni din molecula HDouăstiu.
Cu toate acestea, ca atare, existența hidrurii de seleniu nu poate fi teoretic exclusă. De fapt, cu prezența anionilor H- Ar facilita legăturile Se-H-Se, responsabile de structurile solide formate la presiuni enorme, conform studiilor de calcul.
Aplicații
Metabolic
Deși pare contradictoriu, în ciuda marii toxicități a HDouăEste produs în organism pe calea metabolică a seleniului. Cu toate acestea, de îndată ce este produs, celulele îl folosesc ca intermediar în sinteza selenoproteinelor, sau ajunge să fie metilat și excretat; unul dintre simptomele acestui lucru este gustul usturoiului din gură.
Industrial
HDouăEste folosit în principal pentru a adăuga atomi de seleniu structurilor solide, cum ar fi materialele semiconductoare; la molecule organice, cum ar fi alchenele și nitrilii pentru sinteza selenidelor organice; sau la o soluție pentru precipitarea selenidelor metalice.
Referințe
- Wikipedia. (2018). Selenură de hidrogen. Recuperat de pe: en.wikipedia.org
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Atomism. (2012). Selenură de hidrogen, HDouăStiu. Recuperat de pe: selenium.atomistry.com
- Tang Y. & col. (2017). Selenură de hidrogen (HDouăSe) Gaz dopant pentru implantarea seleniului. A 21-a conferință internațională despre tehnologia implantării de ioni (IIT). Tainan, Taiwan.
- Formulare chimică. (2018). Selenură de hidrogen. Recuperat de pe: formulacionquimica.com
- PubChem. (2019). Selenură de hidrogen. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Zhang, S. și colab. (2015). Diagrama fazelor și supraconductivitatea la temperaturi ridicate a hidrurilor de seleniu comprimate. Rep. Științifică. 5, 15433; doi: 10.1038 / srep15433.
- Acids.Info. (2019). Acid selenhidric: proprietăți și aplicații ale acestui hidracid. Recuperat de la: acidos.info/selenhidrico



Nimeni nu a comentat acest articol încă.