
Proprietăți, reacții și utilizări ale acidului silicic

acid silicic este o formă hidratată de oxid de siliciu. Este denumirea generală a familiei de compuși chimici formați dintr-un siliciu și o anumită cantitate de molecule de hidrogen și oxigen..
Formula generală a acestor acizi este [SiOX(OH)4-2x]n, iar cea mai comună formă în care se găsește de obicei este în cea a acidului ortosilicic H4da4.
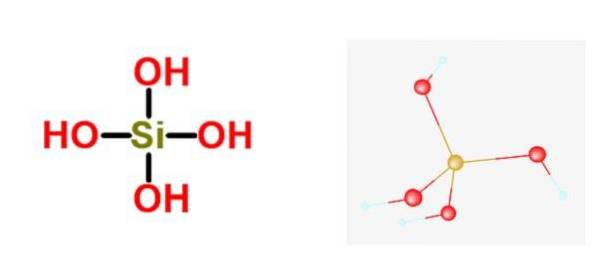
Acidul silicic face parte din familia Diverse silicați. Aceasta înseamnă că cel mai mare oxoanion metalic este silicatul și că nu este atașat niciun atom nemetalic la acesta. Există câteva cazuri izolate în care au un atom nemetalic, dar niciodată mai mult de unul.
Proprietăți fizice ale acidului silicic
Acidul silicic există doar în două stări, amorfă și cristalină. Primul este obținut printr-un proces de precipitare și al doilea este prezentat ca cristal de rocă.
Acid silicic în forma sa amorfă (SiO3) este alb, insipid, insolubil în apă și nu formează cu molecule din ea însăși o masă plastică coezivă, așa cum se întâmplă cu aluminiu.
În starea sa cristalină, nu este dizolvat de niciun oxacid. Când o soluție foarte diluată de soluție de silice este tratată cu acid sulfuric, azotic sau clorhidric, acidul silicic nu este precipitat. În schimb, pare a fi dizolvat în apă sub formă de hidrat.
Când o soluție de acid sau acid este adăugată la o soluție de silicat, hidratul este precipitat într-o formă gelatinoasă care, atunci când este uscat și ulterior încălzit cu mare energie, devine o substanță insolubilă.
Reacții chimice
Acidul silicic este extrem de slab și își pierde primul proton doar când se apropie de pH 10. Doar 3 reacții cunoscute cu acest acid au loc în condiții fiziologice normale de viață..
- Reacția cu sine însuși atunci când solubilitatea este depășită pentru a forma silicat hidrat amorf.
- Reacția sa cu hidroxid de aluminiu pentru a forma hidroxid de silicat de aluminiu.
- Reacția cu excesul de molibdat pentru a forma heteropolioacizi precum silicomolibdat.
Unde se găsește acidul silicic?
După oxigen, siliciul este cel mai frecvent element din natură, este sub formă de cristale. Când este în mediu apos devine neionizant, astfel încât sărurile de siliciu din ocean pot acidifica siliciul și pot crea acid silicic..
Intrările nete de acid silicic în oceanul mondial au fost găsite la 6,1 ± 2,0 teramoli de siliciu pe an (1 teramol = 1012 moli). Aproape 80% din această contribuție provine din râuri a căror concentrație medie globală este de 150 micromolari (concentrație în apă).
În sedimentele marine moderne, producția netă de siliciu biogen (transformarea silicatului dizolvat în material scheletic sub formă de particule) este de 7,1 ± 1,8 teramoli pe an.
Producția brută de silice biogenă în apele de suprafață este de 240 ± 40 teramoli de siliciu pe an, iar raportul de conservare (acumularea de opale în sedimente / producția brută în apele de suprafață) este de 3%..
În floră se găsește în plantă Borago officinalis (Borraje), care în compoziția sa are până la 2,2% acid silicic.
Acidul ortosilicic este cea mai comună formă de acid silicic, care poate fi găsit în multe locuri diferite. Cele mai mari surse biodisponibile ale acestui acid se găsesc în apă, fie în apa de mare, fie în alte băuturi, cum ar fi berea..
Pentru a-l obține în laborator, urmează același principiu ca și în ocean, poate fi obținut prin acidificarea silicatului de sodiu într-o soluție apoasă..
Utilizări în viața de zi cu zi
Pastă de dinţi
Este gelul abraziv utilizat în pasta de dinți sau în partea limpede a pastei de dinți zgâriată, deoarece, în combinație cu carbonat de calciu, ajută la îndepărtarea în siguranță a plăcii cu periaj.
Este înregistrat ca un compus sigur la Administrația pentru Alimente și Medicamente din Statele Unite și nu are toxicitate sau carcinogenitate cunoscută.
Desicant
Când este uscat într-un cuptor, pierde apă și devine un desicant (o substanță care atrage apa din aer). Prin urmare, pachetele mici de cristale de silicagel pot fi găsite în recipiente al căror conținut poate fi deteriorat de umiditate, cum ar fi sticle de vitamine, electronice, pantofi sau produse din piele..
Alte utilizări
Poate fi găsit în magazinele de cadouri, cum ar fi pietrele magice, grădina chimică sau grădina de cristal. Forma sa uscată este amestecată cu săruri de diferite metale.
Când sodiul este aruncat în apă, acesta este înlocuit de metal și, din moment ce silicatul metalic nu este solubil în apă, se formează un precipitat de culoarea caracteristică a metalului. Silicatul metalic se extinde și ca gel și crește ca stalagmite colorate în apă..
Beneficiile medicale ale acidului ortosilicic (OSA)
Acidul ortosilicic este cel mai bun mediu de siliciu biodisponibil pentru oameni. Poate fi utilizat pentru tratarea diferitelor afecțiuni de sănătate, cum ar fi boala Alzheimer, artrita, ateroscleroza, hipertensiunea, bolile de inimă, osteoporoza, accidentul vascular cerebral și părul.
Sănătatea oaselor
Într-un studiu din 2008 pe 136 de femei cu osteopenie, li s-a administrat acid ortosilicic împreună cu calciu și vitamina D sau un placebo în fiecare zi timp de un an. După un an, participanții care au primit acid s-au îmbunătățit în formarea oaselor.
Oamenii de știință spun că acest lucru se datorează capacității acidului ortosilicic de a stimula producția de colagen (o proteină care se găsește în țesutul conjunctiv) și de a promova dezvoltarea celulelor care formează os..
Sănătatea părului
Un mic studiu publicat în 2007 sugerează că acest acid poate ajuta la îmbunătățirea calității și sănătății părului. În studiu, 48 de femei cu „păr fin” au fost împărțite în două grupuri și li s-a administrat un placebo sau un supliment de ortosilicon timp de nouă luni..
Cercetătorii au descoperit că acidul ortosalicilic pare să crească rezistența și grosimea părului. În general, calitatea părului a fost îmbunătățită și cu suplimentarea cu acid ortosalicilic.
Referințe
- Centrul Național pentru Informații despre Biotehnologie. Baza de date compusă PubChem; CID = 14942. Recuperat de la: pubchem.ncbi.nlm.nih.gov.
- Graham, T. (1863). Despre proprietățile acidului silicic și ale altor substanțe coloidale analoage. Proceedings of the Royal Society of London, 13, 335-341. Recuperat de pe: jstor.org.
- Editorii Enciclopediei Britanice (1998) Compus chimic cu acid silicic. Enciclopedia Britanică. Recuperat de pe: britannica.com.
- Tomsofmaine.com. (2017). Silice hidratată | Tom este din Maine. [online] Recuperat de pe: tomsofmaine.com.
- William Thomas Brande, Alfred Swaine Taylor. Chimie. Blanchard și Lea. [online] Adus pe 21 martie 2017 de pe books.google.co.ve.id.
- Field, S. (2017). Silice hidratată. [online] Adus pe 22 martie 2017 de pe: sci-toys.com.



Nimeni nu a comentat acest articol încă.