
Structura acidului iodic (HIO3), proprietăți, riscuri și utilizări

acid iodic este un compus anorganic cu formula HIO3. Este un acid oxacid de iod, care are o stare de oxidare de +5 în această moleculă. Acest compus este un acid foarte puternic și este adesea utilizat pentru standardizarea soluțiilor de baze slabe și puternice pentru a le prepara pentru titrări..
Se formează prin oxidarea iodului diatomic cu acid azotic, clor, peroxid de hidrogen sau acid clorhidric așa cum se arată în următoarea reacție: IDouă + 6HDouăO + 5CIDouă ⇌ 2HIO3 + 10HCI.
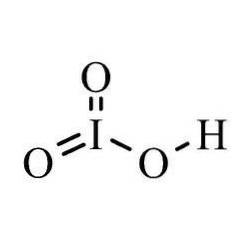
În fiecare reacție, iodul diatomic pierde electroni și formează un complex cu hidrogen și oxigen. Datorită proprietăților sale ionice și solubile, acidul ionic este, de asemenea, un acid foarte puternic..
Indice articol
- 1 Proprietățile fizice și chimice ale acidului iodic
- 2 Reactivitate și pericole
- 3 Utilizări și beneficii pentru sănătate
- 4 Referințe
Proprietățile fizice și chimice ale acidului iodic
Acidul iodic este un solid alb la temperatura camerei (Royal Society of Chemistry, 2015).

Acidul iodic are o greutate moleculară de 175,91 g / mol și are o densitate de 4,62 g / ml. Este foarte solubil în apă, fiind capabil să dizolve 269 grame de acid la 100 ml. Punctul său de topire este de 110 grade Celsius, unde începe să se descompună deshidratându-se în pentoxid de iod.
Odată cu încălzirea ulterioară a compusului la o temperatură mai ridicată, acesta se descompune pentru a da un amestec de iod, oxigen și oxizi de iod inferior (Centrul Național pentru Informații despre Biotehnologie, S.F.).
Este un acid relativ puternic cu o aciditate de 0,75. Iodul sau ionul de iod este produsul acestui compus atunci când este oxidat. La un pH foarte scăzut și o concentrație mare de ioni de clorură este redus la triclorură de iod care este un compus galben în soluție.
Reactivitate și pericole
Acidul iodic este un compus stabil în condiții obișnuite. Fiind un acid puternic, este extrem de periculos în caz de contact cu pielea (coroziv și iritant), contact cu ochii (iritant) și în caz de ingestie. În plus, este foarte periculos și în caz de inhalare (ACID IODIC, S.F.).
Cantitatea de leziuni tisulare depinde de lungimea contactului. Contactul cu ochii poate duce la deteriorarea corneei sau la orbire. Contactul cu pielea poate provoca inflamații și vezicule. Inhalarea prafului va provoca iritarea tractului gastro-intestinal sau respirator, caracterizată prin arsură, strănut și tuse..
Supraexpunerea severă poate provoca leziuni pulmonare, sufocare, pierderea cunoștinței sau moarte. Expunerea prelungită poate provoca arsuri ale pielii și ulcerații. Supraexpunerea prin inhalare poate provoca iritații respiratorii..
Inflamația ochiului se caracterizează prin roșeață, udare și mâncărime. Inflamația pielii se caracterizează prin mâncărime, peeling, roșeață sau ocazional vezicule.
Substanța este toxică pentru rinichi, plămâni și mucoase.
Expunerea repetată sau prelungită la substanță poate provoca deteriorarea acestor organe și iritarea ochilor. Expunerea periodică la piele poate provoca distrugerea locală a pielii sau dermatită..
Inhalarea repetată a prafului poate produce diferite grade de iritație respiratorie sau leziuni pulmonare. Inhalarea prelungită a prafului poate provoca iritații respiratorii cronice..
În caz de contact cu ochii, verificați dacă purtați lentile de contact și scoateți-le imediat. Ochii trebuie clătiți cu apă curgătoare timp de cel puțin 15 minute, ținând pleoapele deschise, putând folosi apă rece. Unguentul pentru ochi nu trebuie utilizat.
Dacă substanța chimică intră în contact cu îmbrăcămintea, îndepărtați-o cât mai repede posibil, protejându-vă propriile mâini și corp. Așezați victima sub un duș de siguranță.
Dacă substanța chimică se acumulează pe pielea expusă a victimei, cum ar fi mâinile, pielea contaminată este spălată ușor și cu grijă cu apă curentă și săpun non-abraziv. Dacă iritația persistă, solicitați asistență medicală și spălați hainele contaminate înainte de reutilizare..
Dacă contactul cu pielea este sever, trebuie spălat cu un săpun dezinfectant și acoperiți pielea contaminată cu o cremă antibacteriană..
În caz de inhalare, victima trebuie lăsată să se odihnească într-o zonă bine ventilată. Dacă inhalarea este severă, victima trebuie evacuată într-o zonă sigură cât mai curând posibil și îmbrăcămintea strânsă (gulerul cămășii, centurile sau cravata) ar trebui să fie slăbită..
Dacă victimei îi este greu să respire, trebuie administrat oxigen. În cazul extrem de a nu respira, se efectuează resuscitarea gură la gură. Desigur, trebuie luat în considerare faptul că poate fi periculos pentru persoana care oferă ajutor atunci când materialul inhalat este toxic, infecțios sau coroziv.
Dacă este înghițit, nu provocați vărsături, slăbiți hainele și, dacă victima nu respiră, efectuați resuscitarea gură la gură.
În toate cazurile, trebuie solicitată asistență medicală imediată (Fișa tehnică de securitate a acidului iodic, 2013).
Utilizări și beneficii pentru sănătate
Acidul iodic este utilizat în mod obișnuit ca agent de standardizare pentru soluțiile de baze slabe și puternice. Este un acid puternic care este utilizat în chimia analitică pentru efectuarea titrărilor.
Se folosește cu indicatori de metil roșu sau metil portocaliu pentru a efectua citiri ale punctelor de echivalență în titrări.
Este utilizat în industria sării pentru a sintetiza sarea de sodiu sau iodat de potasiu. Prin utilizarea acestui compus de acid iodic în prepararea sării, conținutul de iod din sare este crescut (Omkar Chemicals, 2016).
Acest compus a fost folosit de mult timp pentru sinteza organică, deoarece are capacitatea de a oxida selectiv compuși organici, având în vedere acțiunea sa de a efectua o analiză echivalentă de oxidare parțială, o tehnică utilă pentru determinarea structurilor (Roger J. Williams, 1937).
Iodul și acidul iodic sunt utilizate ca o combinație eficientă de reactivi pentru iodarea ariilor hidroxi cetone. În lucrarea lui (Bhagwan R. Patila, 2005), o varietate de compuși carbonilici aromatici orto-hidroxi substituiți au fost iodat regioselectiv cu iod și acid iodic cu randamente excelente..
Referințe
- Bhagwan R. Patila, S. R. (2005). Iod și acid iodic: o combinație eficientă de reactivi pentru iodarea ariilor hidroxi cetone. Tetrahedron Letters Volumul 46, Numărul 42, 7179-7181. arkat-usa.org.
- ACID IODIC. (S.F.). Adus de la chemicalland21: chemicalland21.com.
- Fișă tehnică de securitate a acidului iodic. (2013, 21 mai). Adus de la sciencelab: sciencelab.com.
- Centrul Național pentru Informații despre Biotehnologie. (S.F.). Baza de date compusă PubChem; CID = 24345. Adus de la PubChem.
- Omkar Chemicals. (2016, 11 iunie). NATURA ACIDULUI IODIC ȘI UTILIZĂRILE LUI ÎN DIVERSE SCOPURI. Adus de pe blogul oficial Omkar Chemicals: omkarchemicals.com.
- Roger J. Williams, M. A. (1937). SELECTIVITATEA ACIDULUI IODIC ÎN OXIDAREA COMPUȘILOR ORGANICI. jurnalul societății chimice americane 59 (7), 1408-1409.
- Societatea Regală de Chimie. (2015). Acid iodic. Adus de la chemspider: chemspider.com.



Nimeni nu a comentat acest articol încă.