
Structura, proprietățile și utilizările acidului hidroiodic (HI)

acid hidroiodic Este o soluție apoasă de iodură de hidrogen care se caracterizează prin aciditatea sa ridicată. O definiție mai apropiată de terminologia chimică și IUPAC este că este un hidracid, a cărui formulă chimică este HI.
Cu toate acestea, pentru a-l diferenția de moleculele gazoase de iodură de hidrogen, HI (g) este denumit HI (aq). Din acest motiv, în ecuațiile chimice este important să se identifice faza medie sau fizică în care se găsesc reactanții și produsele. Chiar și așa, confuzia dintre iodură de hidrogen și acid hidroiodic este frecventă..
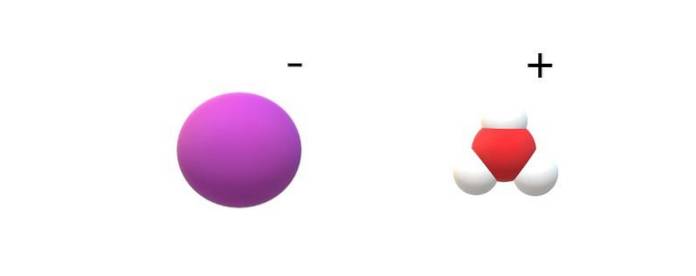
Dacă se observă moleculele comise în identitatea lor, se vor găsi diferențe notabile între HI (g) și HI (ac). În HI (g), există o legătură H-I; în timp ce în HI (ac), ele sunt de fapt o pereche de ioni I- si H3SAU+ interacțiune electrostatică (imaginea de sus).
Pe de altă parte, HI (ac) este o sursă de HI (g), deoarece primul este preparat prin dizolvarea celui de-al doilea în apă. Din această cauză, cu excepția cazului în care se află într-o ecuație chimică, HI poate fi folosit și pentru a se referi la acidul hidroiodic. HI este un agent de reducere puternic și o sursă excelentă de ioni I.- în mediu apos.
Indice articol
- 1 Structura acidului hidroiodic
- 2 Proprietăți
- 2.1 Descrierea fizică
- 2.2 Masa moleculară
- 2.3 Miros
- 2.4 Densitatea
- 2.5 Punctul de fierbere
- 2,6 pKa
- 2.7 Aciditate
- 2.8 Agent de reducere
- 3 Nomenclatură
- 4 utilizări
- 4.1 Sursa de iod în sinteze organice și anorganice
- 4.2 Agent de reducere
- 4.3 Procesul Cativa
- 4.4 Sinteze ilicite
- 5 Referințe
Structura acidului hidroiodic
Acidul hidroiodic, după cum sa explicat, constă dintr-o soluție de HI în apă. Fiind în apă, moleculele HI se disociază complet (electrolitul puternic), originând ionii I- si H3SAU+. Această disociere poate fi reprezentată de următoarea ecuație chimică:
HI (g) + HDouăO (l) => I-(ac) + H3SAU+(ac)
Ce ar fi echivalent dacă ar fi scris ca:
HI (g) + HDouăO (l) => HI (ac)
Cu toate acestea, HI (ac) nu dezvăluie deloc ce s-a întâmplat cu moleculele HI gazoase; indică doar faptul că se află într-un mediu apos.
Prin urmare, adevărata structură a HI (ac) constă din ionii I- si H3SAU+ înconjurat de molecule de apă care le hidratează; cu cât acidul hidroiodic este mai concentrat, cu atât este mai mic numărul de molecule de apă neprotonate.
De fapt, din punct de vedere comercial, concentrația HI este de 48 până la 57% în apă; mai concentrat ar echivala cu a avea acid prea fumuros (și chiar mai periculos).
În imagine, se vede că anionul I- este reprezentat de o sferă mov și H3SAU+ cu sfere albe și una roșie, pentru atomul de oxigen. Cationul H3SAU+ prezintă geometrie moleculară piramidală trigonală (vizualizată dintr-un plan superior din imagine).
Proprietăți
Descriere Fizica
Lichid incolor; dar poate prezenta tonuri gălbui și maro dacă este în contact direct cu oxigenul. Acest lucru se datorează faptului că ionii I- sfârșesc prin a se oxida la iod molecular, IDouă. Dacă sunt multe euDouă, este mai mult decât probabil să se formeze anionul triiodură, I3-, care pata solutia maro.
Masa moleculara
127,91 g / mol.
Miros
Acru.
Densitate
Densitatea este de 1,70 g / ml pentru soluția 57% HI; întrucât densitățile variază în funcție de concentrațiile diferite de HI. La această concentrație se formează un azeotrop (este distilat ca o singură substanță și nu ca un amestec) a cărui stabilitate relativă se poate datora comercializării sale față de alte soluții..
Punct de fierbere
Azeotropul 57% HI fierbe la 127 ° C la o presiune de 1,03 bar (GO TO ATM).
pKa
-1,78.
Aciditate
Este un acid extrem de puternic, atât de mult încât este coroziv pentru toate metalele și țesăturile; chiar și pentru cauciucuri.
Acest lucru se datorează faptului că legătura H-I este foarte slabă și se rupe ușor în timpul ionizării în apă. Mai mult, legăturile de hidrogen I- - HOHDouă+ sunt slabi, deci nu este nimic care să interfereze cu H3SAU+ reacționează cu alți compuși; adică H3SAU+ a fost „liber”, ca și eu- asta nu atrage cu prea multă forță spre contracararea sa.
Agent de reducere
HI este un agent de reducere puternic, al cărui produs de reacție principal este IDouă.
Nomenclatură
Nomenclatura pentru acidul hidroiodic derivă din faptul că iodul „funcționează” cu o singură stare de oxidare: -1. Și, de asemenea, același nume indică faptul că are apă în formula sa structurală [I-] [H3SAU+]. Acesta este singurul său nume, deoarece nu este un compus pur, ci o soluție.
Aplicații
Sursa de iod în sinteze organice și anorganice
HI este o sursă excelentă de ioni I- pentru sinteze anorganice și organice și este, de asemenea, un puternic agent reducător. De exemplu, soluția sa apoasă de 57% este utilizată pentru sinteza iodurilor de alchil (cum ar fi CH3CHDouăI) din alcooli primari. De asemenea, o grupare OH poate fi substituită cu un I într-o structură.
Agent de reducere
Acidul hidroiodic a fost folosit pentru a reduce, de exemplu, carbohidrații. Dacă glucoza dizolvată în acest acid este încălzită, își va pierde toate grupările OH, obținând hidrocarbura n-hexan ca produs..
De asemenea, a fost folosit pentru a reduce grupurile funcționale ale foilor de grafen, astfel încât să poată fi funcționalizate pentru dispozitivele electronice..
Procesul Cativa

Pași
Procesul începe (1) cu complexul organo-iridiu [Ir (CO)DouăEuDouă]-, geometria planului pătrat. Acest compus „primește” iodură de metil, CH3I, produs al acidificării CH3OH cu 57% HI. De asemenea, în această reacție se produce apă și, datorită acesteia, se obține în cele din urmă acid acetic, permițând în același timp recuperarea HI în ultima etapă..
În acest pas atât grupul -CH3 ca -I se leagă de centrul metalului iridiu (2), formând un complex octaedric cu o fațetă formată din trei liganzi I. Unul dintre iodi ajunge să fie înlocuit de o moleculă de monoxid de carbon, CO; iar acum (3), complexul octaedric are o fațetă compusă din trei liganzi CO.
Apoi are loc o rearanjare: grupul -CH3 se „slăbește” din Ir și se leagă de CO (4) adiacent pentru a forma o grupare acetil, -COCH3. Acest grup este eliberat din complexul de iridiu pentru a se lega de ioni de iodură și a da CH3COI, iodură de acetil. Aici este recuperat catalizatorul de iridiu, gata să participe la un alt ciclu catalitic.
În cele din urmă, CH3COI suferă o înlocuire a I- pe o moleculă de HDouăO, al cărui mecanism ajunge să elibereze HI și acid acetic.
Sinteze ilicite

Se poate observa că se produce mai întâi o substituție a grupului OH pentru I, urmată de o a doua substituție pentru un H.
Referințe
- Wikipedia. (2019). Acid hidroiodic. Recuperat de pe: en.wikipedia.org
- Andrews, Natalie. (24 aprilie 2017). Utilizările acidului hidriodic. Știința. Recuperat de pe: sciencing.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Acid hidriodic. Recuperat de pe: alfa.com
- Centrul Național pentru Informații despre Biotehnologie. (2019). Acidul hidriodic. Baza de date PubChem., CID = 24841. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Steven A. Hardinger. (2017). Glosar ilustrat de chimie organică: acid hidroiodic. Recuperat de la: chem.ucla.edu
- Reusch William. (5 mai 2013). Glucidele. Recuperat de la: 2.chemistry.msu.edu
- În Kyu Moon, Junghyun Lee, Rodney S. Ruoff și Hyoyoung Lee. (2010). Oxid de grafen redus prin grafitizare chimică. DOI: 10.1038 / ncomms1067.



Nimeni nu a comentat acest articol încă.